题目内容
【题目】钴和锌是重要的有色金属,其单质及化合物被广泛用于国民经济各个领域。一种从有机废催化剂中回收钴和锌的工艺流程如下:
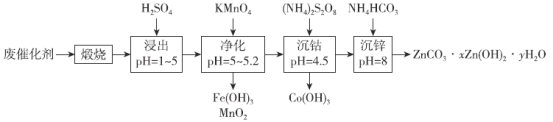
已知:“浸出”后溶液中含有Co2+、Zn2+、Mn2+、Fe2+、Fe3+等。请回答:
(1)“煅烧”的目的为______________________________。
(2)“净化”时,与KMnO4发生反应的所有离子方程式有_____________________________。
(3)“沉钴”时,发生如下反应:(NH4)2S2O8+H2O→NH4HSO4+H2O2;H2O2→H2O+O;···········;Co3++H2O→Co(OH)3+H+。所缺的化学方程式为______________________________;每生成1 molCo(OH)3,理论上消耗(NH4)2S2O8的物质的量为__________。
(4)Co(OH)3沉淀应依次用稀硫酸和水洗涤,检验沉淀是否洗涤干净的方法是____________。
(5)“沉钴”时pH不能太高,其原因为______________________________;“沉锌”时温度不能太高,其原因为________________________________________。
(6)取“沉锌”后所得固体34.1g,煅烧后得到固体24.3g,将生成的气体通过足量的浓硫酸,增重5.4g。则所得固体的化学式为____________。
【答案】除去其中的有机物(或将金属元素转化为氧化物,有利于后续浸出,合理即可) MnO4-+3Fe2++7H2O=MnO2↓+3Fe(OH)3↓+5H+、3Mn2++2MnO4-+2H2O=5MnO2↓+4H+ 2Co2++O+2H+=2Co3++H2O 0.5mol 取最后一次洗涤液少许于试管中,向其加入氯化钡溶液,没有白色沉淀生成,证明洗涤干净 防止Zn2+提前沉淀 防止NH4HCO3热分解 ZnCO32Zn(OH)2H2O
【解析】
将废催化剂高温煅烧,将有机废催化剂中的有机物除去,并将金属元素转化为金属氧化物,用硫酸对煅烧产物进行酸浸,pH控制在1~5,得到含有Co2+、Zn2+、Mn2+、Fe2+、Fe3+的浸出液,调节溶液pH值为5~5.2,加入高锰酸钾将Mn2+、Fe2+氧化并转化为Fe(OH)3和MnO2除去,再次调节溶液pH值为4.5,加入(NH4)2S2O8将Co2+氧化为Co3+并转化为Co(OH)3沉淀除去,调节pH值为8,加入碳酸氢铵使锌离子转化为ZnCO3xZn(OH)2yH2O沉淀,据此分析解答。
(1)“煅烧”可以除去其中的有机物,同时可将金属元素转化为金属氧化物,有利于后续浸出;
(2)“净化”时,加入KMnO4的目的是除去溶液中的Fe2+和Mn2+,反应的离子方程式为:MnO4-+3Fe2+ +7H2O= MnO2↓+3Fe(OH)3↓+5H+、3Mn2++2MnO4-+2H2O=5MnO2↓+4H+;
(3)从流程中可以看出,“沉钴”时,(NH4)2S2O8为氧化剂,因此除去的是Co2+,结合所给反应过程,缺少将Co2+转化为Co3+的反应,则可得所缺的化学方程式为2Co2++O+2H+=2Co3++H2O;根据电荷守恒可得,(NH4)2S2O8~H2O2~O~2Co3+~ 2Co(OH)3,每生成1mol Co(OH)3理论上消耗(NH4)2S2O8的物质的量为0.5mol;
(4) Co(OH)3沉淀应依次用稀硫酸和水洗涤,检验Co(OH)3沉淀是否洗涤干净,也就是检验是否含有硫酸根离子,可取取最后一次洗涤液少许于试管中,向其加入氯化钡溶液,没有白色沉淀生成,证明洗涤干净;
(5)“沉钴”时pH不能太高,防止Zn2+提前沉淀;“沉锌”时,加入NH4HCO3,铵盐受热易分解,温度不能太高,防止NH4HCO3热分解;
(6)取“沉锌”后所得固体34.1g,煅烧后得到固体24.3g,将生成的气体通过足量的浓硫酸,增重5.4g,增重的质量为水,根据质量守恒,煅烧生成的CO2气体的物质的量为![]() =0.1mol,根据元素守恒可知ZnCO3xZn(OH)2yH2O为0.1mol,煅烧后生成的ZnO的物质的量为
=0.1mol,根据元素守恒可知ZnCO3xZn(OH)2yH2O为0.1mol,煅烧后生成的ZnO的物质的量为![]() =0.3mol,根据Zn元素守恒,0.1mol+0.1molx=0.3mol,则x=2,生成水的物质的量为
=0.3mol,根据Zn元素守恒,0.1mol+0.1molx=0.3mol,则x=2,生成水的物质的量为![]() =0.3mol,根据氢元素守恒,0.1mol×2×2+0.1mol×2y=0.3mol×2,则y=1,则所得固体的化学式为ZnCO32Zn(OH)2H2O。
=0.3mol,根据氢元素守恒,0.1mol×2×2+0.1mol×2y=0.3mol×2,则y=1,则所得固体的化学式为ZnCO32Zn(OH)2H2O。

 考前必练系列答案
考前必练系列答案