题目内容
元素R有如下反应:RO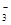 +5R-+6H+===3R2+3H2O,下列说法正确的是( )
+5R-+6H+===3R2+3H2O,下列说法正确的是( )
| A.元素R位于周期表中第ⅤA族 |
B.RO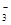 中的R只能被还原 中的R只能被还原 |
C.每反应消耗1 mol RO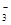 ,转移电子的物质的量为5 mol ,转移电子的物质的量为5 mol |
| D.R2在常温常压下一定是气体 |
C
解析试题分析:A.由于元素R形成的简单阴离子是R-,则其最外层有7个电子,所以元素R位于周期表中第ⅦA族.错误。 B.在RO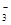 中的R的化合价为+5价,R是第ⅦA族的元素,最高化合价为+7价,最低为-1价,RO
中的R的化合价为+5价,R是第ⅦA族的元素,最高化合价为+7价,最低为-1价,RO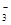 中的R的化合价处于元素R的中间价态,所以键能被氧化,也能被还原。错误。C.由方程式可知:每反应消耗1 mol RO
中的R的化合价处于元素R的中间价态,所以键能被氧化,也能被还原。错误。C.由方程式可知:每反应消耗1 mol RO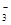 ,转移电子的物质的量为5 mol。正确。D.R2在常温常压下可能是气体,也可能是液体或固体。错误。
,转移电子的物质的量为5 mol。正确。D.R2在常温常压下可能是气体,也可能是液体或固体。错误。
考点:考查元素的位置、结构、与性质的关系的知识。

练习册系列答案
相关题目
下列叙述中错误的是 ( )
| A.原子半径:Cl>S>O | B.还原性:Na>Mg>Al |
| C.稳定性:HF>HCl>HBr | D.酸性:HClO4>H2SO4>H3PO4 |
X、Y、Z是原子序数依次递增的短周期元素,3种元素的原子核外电子数之和与Ca2+的核外电子数相等,X、Z分别得到一个电子后均形成稀有气体原子的稳定电子层结构。下列说法正确的是
| A.Z与X形成化合物的沸点高于Z的同族元素与X形成化合物的沸点 |
| B.原子半径:Z>Y>X |
| C.CaY2与水发生氧化还原反应时,CaY2只作氧化剂 |
| D.CaY2和CaZ22种化合物中,阳离子与阴离子个数比均为1︰2 |
下列说法正确的是
| A.第一电离能越小的元素其单质金属活泼性一定越大 |
| B.电负性越小的元素金属性一定越强 |
| C.元素电负性相差小于1.7的元素之间形成的化学键一定为共价键 |
| D.制造光电材料的元素主要从IA族中寻找其主要原因是IA的第一电离能比较低 |
四种短周期元素在周期表中的位置如图,其中只有M为金属元素。下列说法不正确的是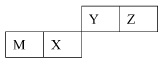
| | Y | Z | |
| M | X | | |
B.Y的最高价氧化物对应水化物的酸性比X 的弱
C.X 的最简单气态氢化物的热稳定性比Z的小
D.Z位于元素周期表中第2 周期、第ⅥA族
已知34Se和35Br位于同一周期,下列关系正确的是
| A.原子半径:Br>Se>Cl | B.热稳定性:HCl>H2Se>HBr |
| C.酸性:H2SeO4>HBrO4>HClO4 | D.还原性:Se2—>Br—>Cl— |
几种短周期元素的原子半径及主要化合价如下表,相关说法正确的是
| 元素代号 | L | M | X | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
C.煤和石油中存在X元素 D.L、X形成的简单离子核外电子数相等
(3分)(2012?山东)下列关于原子结构、元素性质的说法正确的是( )
| A.非金属元素组成的化合物中只含共价键 |
| B.ⅠA族金属元素是同周期中金属性最强的元素 |
| C.同种元素的原子均有相同的质子数和中子数 |
| D.ⅦA族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强 |