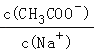题目内容
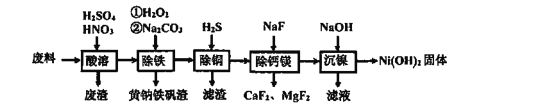
【题目】根据实验室制备氯气的装置(如下),回答下列问题;
(1)仪器A 和 B名称___________ ;____________
(2)写出B中发生反应的离子方程式_____________________________________
(3)装置C的作用__________________________________________
(4)装置D的作用________________________________________________
(5)检验E中氯气已经收集满的方法_________________________________________
(6)写出F中发生的反应方程式______________________________________________
(7)每生成0.5mol氯气转移________________个电子
【答案】分液漏斗 圆底烧瓶 MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O 除去氯气中的HCl 除去氯气中的水蒸气 E装置右端的导管口放置湿润的淀粉碘化钾试纸,试纸变蓝,则证明氯气收集满 Cl2+2NaOH=NaCl+NaClO+H2O NA
Mn2++Cl2↑+2H2O 除去氯气中的HCl 除去氯气中的水蒸气 E装置右端的导管口放置湿润的淀粉碘化钾试纸,试纸变蓝,则证明氯气收集满 Cl2+2NaOH=NaCl+NaClO+H2O NA
【解析】
(1)根据装置图示判断仪器名称;
(2)浓盐酸与二氧化锰在加热条件下反应制取氯气;
(3)制取的氯气中含有挥发出来的氯化氢;
(4)制取的氯气中含有水蒸汽;
(5)氯气可使湿润的淀粉碘化钾试纸变蓝;
(6)氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水;
(7)根据反应MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O,结合氧化还原反应规律分析计算。
Mn2++Cl2↑+2H2O,结合氧化还原反应规律分析计算。
(1)由图可知,A为分液漏斗,B为圆底烧瓶;
(2)用二氧化锰和浓盐酸制取氯气的离子方程式为:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(3)制取的氯气中混有HCl和水蒸气,装置C中饱和食盐水的作用是除去氯气中的HCl;
(4)制取的氯气中含有水蒸汽,装置D中浓硫酸的作用是除去氯气中的水蒸气;
(5)氯气可使湿润的淀粉碘化钾试纸变蓝,E装置右端的导管口放置湿润的淀粉碘化钾试纸,试纸变蓝,则证明氯气收集满;
(6)氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,方程式为:Cl2+2NaOH=NaCl+NaClO+H2O;
(7)根据离子反应方程式:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O,生成1mol氯气反应中转移2mol电子,则每生成0.5mol氯气转移1mol电子,则电子数目为NA个。
Mn2++Cl2↑+2H2O,生成1mol氯气反应中转移2mol电子,则每生成0.5mol氯气转移1mol电子,则电子数目为NA个。

【题目】室温下,将0.05molCH3COONa固体溶于水配成100mL溶液,向溶液中加入下列物质充分混合后,有关结论不正确的是( )
加入的物质 | 结论 | |
A | 0.05molCH3COONa固体 |
|
B | 0.05molNaHSO4固体 | c(CH3COO﹣)+c(CH3COOH)=c(Na+)﹣c(SO42﹣) |
C | 0.05molNH4Cl固体 | 水电离程度增大 |
D | 50mLH2O | 由水电离出的c(H+)·c(OH﹣)减小 |
A. AB. BC. CD. D