题目内容
【题目】氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理对于消除环境污染有重要意义。回答下列问题:
(1)NO2和N2O4以物质的量之比为1:1与O2和H2O恰好完全反应的化学方程式为_____。
(2)已知:2N2O5(g)![]() 2N2O4(g)+O2(g) H=-4.4kJ/mol
2N2O4(g)+O2(g) H=-4.4kJ/mol
N2O5(g)![]() 2NO2(g)+
2NO2(g)+![]() O2(g) H =+53.1 kJ/mol
O2(g) H =+53.1 kJ/mol
则反应2NO2(g)![]() N2O4(g)的H=___kJ/mol。
N2O4(g)的H=___kJ/mol。
(3)利用现代手持技术传感器可以探究压强对2NO2(g)![]() N2O4(g)化学平衡移动的影响。在恒定温度和标准压强(100kPa)条件下,往针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在t1、t2时刻迅速移动活塞后并保持活塞位置不变(不考虑温度的变化)。测定针筒内气体压强变化如图所示:
N2O4(g)化学平衡移动的影响。在恒定温度和标准压强(100kPa)条件下,往针筒中充入一定体积的NO2气体后密封并保持活塞位置不变。分别在t1、t2时刻迅速移动活塞后并保持活塞位置不变(不考虑温度的变化)。测定针筒内气体压强变化如图所示:
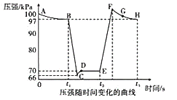
①B点时NO2的转化率为___;B点反应N2O4![]() 2NO2(g)的平衡常数Kp为____(Kp为以分压表示的平衡常数,计算结果保留1位小数)。
2NO2(g)的平衡常数Kp为____(Kp为以分压表示的平衡常数,计算结果保留1位小数)。
②B、E两点对应的正反应速率大小为νB___νE(请填“>”“<”或“=”)。
③E、F、G、H四点时对应气体的平均相对分子质量最大的点为___。
(4)反应物NO2可由2NO(g)+O2(g)![]() 2NO2生成,对该反应科学家提出如下反应历程:
2NO2生成,对该反应科学家提出如下反应历程:
第一步NO+NO![]() N2O2 快速平衡
N2O2 快速平衡
第二步N2O2+O2→2NO2 慢反应
下列说法正确的是_____(填标号)。
A.若第一步放热,温度升高,总反应速率可能减小
B.N2O2为该反应的催化剂
C.第二步反应的活化能比第一步反应的活化能大
D.第二步中N2O2与O2的碰撞100%有效
【答案】4NO2+4N2O4+3O2+6H2O=12HNO3 -55.3 6% 3036.4 > H AC
【解析】
(1)NO2和N2O4以物质的量之比为1:1与O2和H2O恰好完全反应,反应中氧气为氧化剂,化合价由0价变为-2价,氮元素化合价应升高被氧化,则为+5价,化合价升(1+1×2)×(5-4)=3,降为2×2=4,最小公倍数为12,结合质量守恒可得化学方程式为4NO2+4N2O4+3O2+6H2O=12HNO3;
(2)已知:①2N2O5(g)![]() 2N2O4(g)+O2(g) H1=-4.4kJ/mol
2N2O4(g)+O2(g) H1=-4.4kJ/mol
②N2O5(g)![]() 2NO2(g)+
2NO2(g)+![]() O2(g) H2=+53.1 kJ/mol
O2(g) H2=+53.1 kJ/mol
根据盖斯定律,由①×![]() -②得反应2NO2(g)
-②得反应2NO2(g)![]() N2O4(g) H=-4.4kJ/mol×
N2O4(g) H=-4.4kJ/mol×![]() -53.1 kJ/mol=-55.3 kJ/mol;
-53.1 kJ/mol=-55.3 kJ/mol;
(3)①根据阿伏加德罗定律,温度,体积不变时,压强之比等于物质的量之比,设起始时NO2的物质的量为n,反应的物质的量为2x,列出三段式:
2NO2(g)![]() N2O4(g)
N2O4(g)
起始/mol n 0
反应/mol 2x x
平衡/mol n-2x x
气体物质的量之比等于压强之比,则![]() =
=![]() ,x=
,x=![]() ,NO2的转化率为
,NO2的转化率为![]() ×100%=
×100%=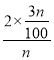 ×100%=6%;n-2x=n-2×
×100%=6%;n-2x=n-2×![]() =
=![]() ,n-2x+x=
,n-2x+x=![]() ,则B点反应N2O4
,则B点反应N2O4![]() 2NO2(g)的平衡常数Kp为
2NO2(g)的平衡常数Kp为 =3036.4;
=3036.4;
②压强影响气体的化学反应速率,压强增大,化学反应速率加快,B点的压强大于E点的压强,则νB>νE;
③t2时刻移动了活塞,压强迅速增大,说明针筒内体积缩小,保持活塞位置不变后,平衡向着正向移动,混合气的物质的量逐渐减小,根据M=![]() ,可知,E、F、G、H四点时对应气体的平均相对分子质量最大的点为H;
,可知,E、F、G、H四点时对应气体的平均相对分子质量最大的点为H;
(4)A.若第一步放热,温度升高,平衡逆向移动,使第二步N2O2的量减少,总反应速率可能减小,选项A正确;
B.N2O2为该反应的中间产物,不是催化剂,选项B错误;
C.降低活化能,可加快反应速率,则第二步的活化能比第一步的高,选项C正确;
D.第二步反应较慢,则有效碰撞的次数较少,可知N2O2与O2的碰撞不可能100%有效,选项D错误。
答案选AC。