题目内容
【题目】按要求填空:
(一)某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)甲组同学取2mLFeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为_______。
(2)乙组同学认为甲组的实验不够严谨,该组同学在2mLFeCl2溶液中先加入0.5mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是________。
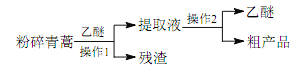
(二)、工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如下(金属单质E可由滤液C制取):
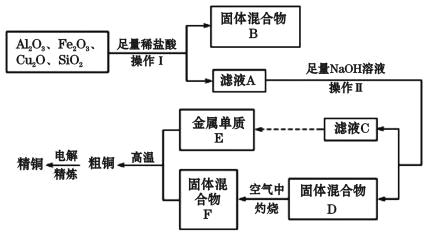
已知:Cu2O+2H+ =Cu+Cu2+ +H2O。
(3)固体混合物B的成分是____。
(4)滤液A中铁元素的存在形式为____(填离子符号),生成该离子与Fe元素的有关反应的离子方程式为_________、_____。
(5)向滤液C中通入足量CO2气体,除了CO2+OH-=HCO3-,主要的离子方程式有________。
【答案】Cl2+2Fe2+=2Fe3++2Cl- 隔离空气(或排除氧气对实验的影响) SiO2和Cu Fe2+ Fe2O3+6H+=2Fe3++3H2O 2Fe3++Cu=2Fe2++Cu2+ AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
【解析】
(一)(1)氯气具有氧化性,能将氯化亚铁氧化,据此分析书写反应的离子方程式;
(2)煤油不溶于水,密度比水小,分层后可以隔离溶液与空气接触,结合空气中含有氧气分析解答;
(二)矿渣中含有Cu2O、Al2O3、Fe2O3、SiO2,Cu2O与盐酸反应生成Cu和Cu2+,SiO2与盐酸不反应,Fe2O3与盐酸反应生成Fe3+,与Cu反应生成Fe2+,固体混合物B为SiO2和Cu,滤液A中含有Cu2+、Fe2+、Al3+,加入足量的NaOH溶液,滤液C中含有AlO2-,金属E为Al,固体D为Cu(OH)2和Fe(OH)3的混合物,在空气中灼烧,F为CuO和Fe2O3的混合物,粗铜为Cu、Al和Fe的混合物,经过电解可得纯铜,据此分析解答(3)~(5)。
(一)(1)氯气具有氧化性,能氧化氯化亚铁为氯化铁,反应的离子方程式为:Cl2+2Fe2+=2Fe3++2Cl-,故答案为:Cl2+2Fe2+=2Fe3++2Cl-;
(2)煤油不溶于水,密度比水小,分层后可以隔离溶液与空气接触,排除氧气对实验的影响,故答案为:隔离空气(或排除氧气对实验的影响);
(二)(3)根据上述分析,矿渣中含有Cu2O、Al2O3、Fe2O3、SiO2,只有SiO2与盐酸不反应,且Cu2O在酸性溶液中发生歧化反应生成铜,则固体B为SiO2和Cu,故答案为:SiO2和Cu;
(4)Cu2O与盐酸反应生成Cu和Cu2+,Fe2O3与盐酸反应生成Fe3+,Fe2O3+6H+=2Fe3++3H2O,反应生成的Fe3+能够与Cu反应生成Fe2+,2Fe3++Cu=2Fe2++Cu2+,有Cu剩余,则溶液中铁离子转化为亚铁离子,所以滤液A中铁元素的存在形式为Fe2+,故答案为:Fe2+;Fe2O3+6H+=2Fe3++3H2O、2Fe3++Cu=2Fe2++Cu2+;
(5)在滤液C中含氢氧化钠和偏铝酸钠溶液,通入足量CO2反应生成碳酸氢钠,氢氧化铝,反应的离子方程式为:OH-+CO2=HCO3-;AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-。

 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案【题目】某碳素钢锅炉内水垢的主要成分是碳酸钙、硫酸钙、氢氧化镁、铁锈、二氧化硅等。水垢会形成安全隐患,需及时清洗除去。清洗流程如下:
Ⅰ.加入NaOH和Na2CO3混合液,加热,浸泡数小时;
Ⅱ.放出洗涤废液,清水冲洗锅炉,加入稀盐酸和少量NaF溶液,浸泡;
Ⅲ.向洗液中加入Na2SO3溶液;
Ⅳ.清洗达标,用NaNO2溶液钝化锅炉。
(1)用NaOH溶解二氧化硅的化学方程式是__________________________________。
(2)已知:20℃时溶解度/g
CaCO3 | CaSO4 | Mg(OH)2 | MgCO3 |
1.4×10-3 | 2.55×10-2 | 9×10-4 | 1.1×10-2 |
根据数据,结合化学平衡原理解释清洗CaSO4的过程________________________。
(3)在步骤Ⅱ中:
① 被除掉的水垢除铁锈外,还有_______________________________________。
② 清洗过程中,溶解的铁锈会加速锅炉腐蚀,用离子方程式解释其原因________。
(4)步骤Ⅲ中,加入Na2SO3的目的是_______________________。
(5)步骤Ⅳ中,钝化后的锅炉表面会覆盖一层致密的Fe2O3保护膜。
① 完成并配平其反应的离子方程式:______
![]()
②下面检测钝化效果的方法合理的是______。
a.在炉面上滴加浓H2SO4,观察溶液出现棕黄色的时间
b.在炉面上滴加酸性CuSO4溶液,观察蓝色消失的时间
c.在炉面上滴加酸性K3[Fe(CN)6]溶液,观察出现蓝色沉淀的时间
d.在炉面上滴加浓HNO3,观察出现红棕色气体的时间
【题目】氯化铵焙烧菱锰矿制备高纯度碳酸锰的工艺流程如下:
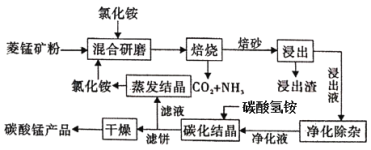
已知:①菱锰矿石主要成分是MnCO3,还含有少量Fe、Al、Ca、Mg等元素;
②常温下,CaF2、MgF2的溶度积分别为1.46×10-10、7.42×10-11
③相关金属离子c(Mn+)=0.1mol/L形成氯氧化物沉淀时的pH如下:
回答下列问题:
金属离子 | Al3+ | Fe3+ | Fe2+ | Ca2+ | Mn2+ | Mg2+ |
开始沉淀的pH | 3.8 | 1.5 | 6.3 | 10.6 | 8.8 | 9.6 |
沉淀完全的pH | 5.2 | 2.8 | 8.3 | 12.6 | 10.8 | 11.6 |
(1)“焙烧”时发生的主要化学反应方程式为______________________。
(2)分析下列图1、图2、图3,氯化铵焙烧菱镁矿的最佳条件是:
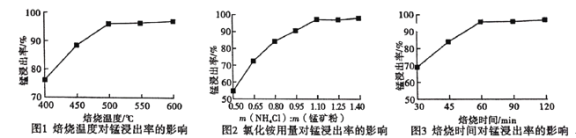
焙烧温度_________,氯化铵与菱镁矿粉的质量之比为__________,焙烧时间为___________.
(3)浸出液“净化除杂”过程如下:首先加入MnO2将Fe2+氧化为Fe3+,反应的离子方程式为________;然后调节溶液pH使Fe3+、Al3+沉淀完全,此时溶液的pH范围为____。再加入NH4F沉淀Ca2+、Mg2+,当c(Ca2+)=1.0×10-5mol/L时, c(Mg2+)=______mol/L
(4)碳化结晶时,发生反应的离子方程式为_____________________________________________。
(5)流程中能循环利用的固态物质是____________。