题目内容
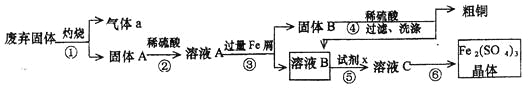
【题目】(14分)按下图所示装置进行实验,并回答下列问题:

(1)判断装置的名称:A池为 ,B池为 ;
(2)锌极为 极,铜极上的电极反应式为 ,
石墨棒C1为 极,电极反应式为 ,
石墨棒C2附近产生的现象为 ;
(3)当C2极析出气体224mL(标准状况),锌的质量变化为 g(“增加”或“减少”)。
【答案】(1)原电池,电解池 (2)负极,Cu2+ + 2 e— =Cu ,阳极,2Cl——2e— = Cl2↑,有无色气泡产生附近溶液变红色,(3)减少 0.65
【解析】
试题(1)根据装置特点,A池存在自发的氧化还原反应,则A池为原电池,B池为电解池;
(2)锌比铜活泼,锌极为负极,铜极为正极,铜极上的电极反应为Cu2+ + 2 e— =Cu,石墨棒C1与正极相连,为阳极,电极反应式为2Cl——2e— = Cl2↑,B池为电解氯化钾溶液,石墨棒C2为阴极,在阴极生成氢气和氢氧化钾,则附近产生的现象为有无色气泡产生附近溶液变红色;
(3)根据电子守恒,阴极:2H++2e-=H2↑负极:Zn-2e-=Zn2+当C2极析出气体224mL(标准状况),气体的物质的量为0.01mol,转移电子0.02mol,则锌的质量减少0.65g。

【题目】向物质X中逐渐加入(或通入)Y溶液,生成沉淀的量与加入Y的物质的量关系如图所示,下表中符合图示情况的是
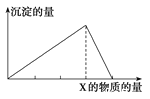
A | B | C | D | |
X | CO2 | HCl | NaOH | AlCl3 |
Y | Ca(OH)2 | NaAlO2 | AlCl3 | NaOH |
A.AB.BC.CD.D
【题目】(1)氮化硼、氮化铝、氮化镓的结构类似于金刚石,熔点如表中所示:
物质 | BN | AIN | GaN |
熔点/℃ | 3000 | 2200 | 1700 |
试从结构的角度分析它们熔点不同的原因___________________________________。
(2)N、P、As位于同一主族,基态氮原子的核外共有________种不同运动状态的电子,与PO43-互为等电子体的分子有________________(填一种即可)。
(3)铬原子的最高能层符号是_______,其价电子轨道表示式为____________________。
(4)比较第二电离能Cu_______Zn(填“>”、“=”、“<")。
(5)AuCl3是一种褐红色晶体,吸湿性极强,易溶于水和乙醇,无论是固态、还是气态,它都是以二聚体Au2Cl6的形式存在。写出Au2Cl6的结构式__________________________.
(6)已知Zn2+、Au+均能与CN-形成配离子, Zn2+与CN-形成的配离子为正四面体形,Au+与CN-形成的配离子为直线形. 工业上常用Au+和CN-形成的配离子与Zn单质反应来提取Au单质,写出该反应的离子方程式___________________________________________________________________________________ 。