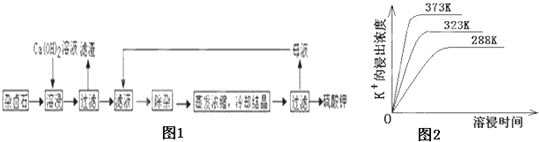
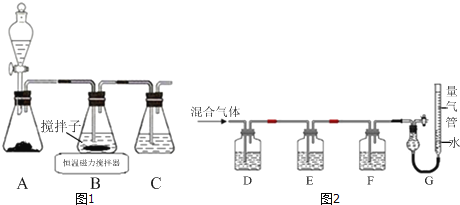
ЬтФПФкШн
ЁОЬтФПЁПЖўбѕЛЏЬМЕФВЖМЏЁЂРћгУгыЗтДцЪЧЮвЙњФмдДСьгђЕФвЛИіживЊеНТдЗНЯђЃЌЗЂеЙГЩвЛЯюживЊЕФаТаЫВњвЕЁЃ
ЃЈ1ЃЉвбжЊЃКCH4ЁЂCOЁЂH2ЕФШМЩеШШЗжБ№ЮЊ890kJЁЄmol-1ЁЂ283kJЁЄmol-1ЁЂ285.5kJЁЄmol-1ЃЌМЦЫуЯТСаЗДгІЕФЗДгІШШЃКCO2(g)+CH4(g)=2CO(g)+2H2(g) ЁїHЃН___kJЁЄmol-1ЁЃ
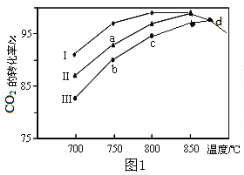
ЃЈ2ЃЉРћгУЗЯЦјжаЕФCO2ЮЊдСЯжЦШЁМзДМЃЌЗДгІЗНГЬЪНЮЊЃКCO2+3H2![]() CH3OH+H2OЦфЫћЬѕМўЯрЭЌЃЌИУМзДМКЯГЩЗДгІдкВЛЭЌДпЛЏМСЃЈIЁЂIIЁЂIIIЃЉзїгУЯТЗДгІЯрЭЌЪБМфКѓЃЌCO2ЕФзЊЛЏТЪЫцЗДгІЮТЖШЕФБфЛЏШчЭМ1ЫљЪОЁЃ
CH3OH+H2OЦфЫћЬѕМўЯрЭЌЃЌИУМзДМКЯГЩЗДгІдкВЛЭЌДпЛЏМСЃЈIЁЂIIЁЂIIIЃЉзїгУЯТЗДгІЯрЭЌЪБМфКѓЃЌCO2ЕФзЊЛЏТЪЫцЗДгІЮТЖШЕФБфЛЏШчЭМ1ЫљЪОЁЃ
ЂйИУЗДгІЕФЁїH__0ЃЈЬюЁАЉЁБЛђЁАЉЁБЃЉЁЃ
ЂкdЕуВЛЭЌДпЛЏМСЃЈIЁЂIIЁЂIIIЃЉзїгУЯТCO2ЕФзЊЛЏТЪЯрЭЌЕФдвђЪЧ___ЁЃ
ЃЈ3ЃЉгУЖўбѕЛЏЬМДпЛЏМгЧтРДКЯГЩЕЭЬМЯЉЬўЃЌЦ№ЪМЪБвд0.1MPaЃЌn(H2)ЃКn(CO2)=3ЃК1ЕФЭЖСЯБШГфШыЗДгІЦїжаЃЌЗЂЩњЗДгІЃК2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) ЁїHЃЌВЛЭЌЮТЖШЯТЦНКтЪБЕФЫФжжЦјЬЌЮяжЪЕФЮяжЪЕФСПШчЭМ2ЫљЪОЃК
C2H4(g)+4H2O(g) ЁїHЃЌВЛЭЌЮТЖШЯТЦНКтЪБЕФЫФжжЦјЬЌЮяжЪЕФЮяжЪЕФСПШчЭМ2ЫљЪОЃК
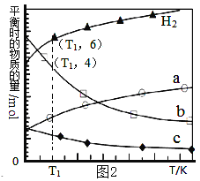
ЂйИУЗДгІдк___здЗЂНјааЃЈЬюЁАЕЭЮТЁБЛђЁАИпЮТЁБЃЉЁЃ
ЂкbДњБэЕФЮяжЪЪЧ___ЁЃ
ЂлT1ЮТЖШЯТЕФЦНКтзЊЛЏТЪЮЊ___ЁЃ
ЁОД№АИЁП+247.6 < dЕуОљДяЕНЦНКтзДЬЌЃЌДпЛЏМСВЛгАЯьЦНКтзЊЛЏТЪ ЕЭЮТ H2O 50%
ЁОНтЮіЁП
ЃЈ1ЃЉИљОнЬтвтЕУЕНЃКЂй![]() ЃЛ
ЃЛ
Ђк![]() ЃЛ
ЃЛ
Ђл![]() ЃЛ
ЃЛ
гЩИЧЫЙЖЈТЩЂй-ЂкЁС2-ЂлЁС2ЕУЕНЃК![]()
![]() =+247.6kJ/molЃЌ
=+247.6kJ/molЃЌ
ЙЪД№АИЮЊЃК+247.6ЃЛ
ЃЈ2ЃЉгЩЭМЯѓПЩвдПДГіЃЌЫцзХЗДгІЕФНјааЃЌЮТЖШж№НЅЩ§ИпЃЌCO2зЊЛЏТЪЯШж№НЅЩ§ИпЃЌШЛКѓж№НЅЯТНЕЃЌЫЕУїЗДгІ![]() ЮЊЗХШШЗДгІЃЌзюКѓзЊЛЏТЪЯрЕШЃЌЦфдвђЪЧdЕуЪЧЗДгІОљвбДяЕНСЫЦНКтзДЬЌЃЌЧвДпЛЏМСВЛгАЯьЦНКтвЦЖЏЃЌ
ЮЊЗХШШЗДгІЃЌзюКѓзЊЛЏТЪЯрЕШЃЌЦфдвђЪЧdЕуЪЧЗДгІОљвбДяЕНСЫЦНКтзДЬЌЃЌЧвДпЛЏМСВЛгАЯьЦНКтвЦЖЏЃЌ
ЙЪД№АИЮЊЃК<ЃЛdЕуОљДяЕНЦНКтзДЬЌЃЌДпЛЏМСВЛгАЯьЦНКтзЊЛЏТЪЃЛ
ЃЈ3ЃЉЂй.ИљОнЭМЪОЧњЯпПЩжЊЃЌЮТЖШЩ§ИпЧтЦјЮяжЪЕФСПдіДѓЃЌЦНКтзѓвЦЃЌЫЕУїе§ЗДгІЮЊЗХШШЗДгІЃЌ![]() <0ЃЌе§ЗДгІЛьТвЖШМѕаЁЃЌМД
<0ЃЌе§ЗДгІЛьТвЖШМѕаЁЃЌМД![]() <0ЃЌЫљвдИљОн
<0ЃЌЫљвдИљОн![]() ЃЌЫЕУїЗДгІФмЙЛздЗЂНјааЃЌМДвЊдкНЯЕЭЮТЯТФмздЗЂНјааЃЌ
ЃЌЫЕУїЗДгІФмЙЛздЗЂНјааЃЌМДвЊдкНЯЕЭЮТЯТФмздЗЂНјааЃЌ
ЙЪД№АИЮЊЃКЕЭЮТЃЛ
Ђк.ИљОнЧтЦјЕФЮяжЪЕФСПБфЛЏЃЌЫЕУїaЪЧCO2ЃЌЫљвдbЁЂcЮЊввЯЉКЭЫЎеєЦјЃЌгЩгкввЯЉгыЫЎеєЦјЕФИФБфСПжЎБШЮЊ1:4ЃЌЫљвдbЮЊH2OЃЌ
ЙЪД№АИЮЊЃКH2OЃЛ
Ђл.T1ЮТЖШЯТaЮЊ2molЃЌввЯЉ(c)ЮЊ1molЃЌЧтЦјЮЊ6molЃЌЫЎеєЦјЮЊ4molЃЌЫЕУїЗДгІЕФЧтЦјЮЊ6molЃЌЫљвдT1ЮТЖШЯТЦНКтзЊЛЏТЪЮЊЃК![]() =50%ЃЌ
=50%ЃЌ
ЙЪД№АИЮЊЃК50%ЁЃ

ЁОЬтФПЁПNOКЭCOЖМЪЧЦћГЕХХЗХЮВЦјжаЕФгаКІЮяжЪЃЌашвЊНјвЛВНДІРэКЭРћгУЁЃ
(1)вбжЊЃКCOПЩНЋВПЗжЕЊЕФбѕЛЏЮяЛЙдЮЊN2ЁЃ
ЗДгІЂёЃК2CO(g)+2NO(g)![]() N2(g)+2CO2(g) ЁїH = Ѓ746 kJЁЄmolЃ1
N2(g)+2CO2(g) ЁїH = Ѓ746 kJЁЄmolЃ1
ЗДгІЂђЃК4CO(g)+2NO2(g)![]() N2(g)+4CO2(g) ЁїH = Ѓ1200 kJЁЄmolЃ1
N2(g)+4CO2(g) ЁїH = Ѓ1200 kJЁЄmolЃ1
аДГіCOНЋNO2ЛЙдЮЊNOЕФШШЛЏбЇЗНГЬЪН__________________ЁЃ
(2)дкУмБеШнЦїжаГфШы5 mol COКЭ4 mol NOЃЌЗЂЩњЩЯЪіЗДгІIЃЌШчЭМЮЊЦНКтЪБNOЕФЬхЛ§ЗжЪ§гыЮТЖШЁЂбЙЧПЕФЙиЯЕЁЃ

ЛиД№ЯТСаЮЪЬтЃК
ЂйЮТЖШЃКT1_________T2(ЬюЁАЃМЁБЛђЁАЃОЁБ)ЁЃ
ЂкФГЮТЖШЯТЃЌдкЬхЛ§ЮЊ2 LЕФУмБеШнЦїжаЃЌЗДгІНјаа10ЗжжгЗХГіШШСП373 kJЃЌгУCOЕФХЈЖШБфЛЏБэЪОЕФЦНОљЗДгІЫйТЪv(CO)=_____________ЁЃЭМжаA~GЕужаЃЌе§ЗДгІЫйТЪзюПьЕФЪЧ______Еу(ЬюађКХ)
ЂлФГЮТЖШЯТЃЌЗДгІДяЕНЦНКтзДЬЌDЕуЪБЃЌШнЦїЬхЛ§ЮЊ2 LЃЌДЫЪБЕФЦНКтГЃЪ§K =_____(НсЙћОЋШЗЕН0.01)ЃЛ
(3)ЙЄвЕЩЯПЩвдРћгУCOгыH2ЗДгІКЯГЩМзДМЃКCO(g)+2H2(g)![]() CH3OH(g) ЁїHЁЃШєдкЮТЖШКЭШнЛ§ЯрЭЌЕФШ§ИіУмБеШнЦїжаЃЌАДВЛЭЌЗНЪНЭЖШыЗДгІЮяЃЌВтЕУЗДгІДяЕНЦНКтЪБЕФгаЙиЪ§ОнШчЯТБэЃК
CH3OH(g) ЁїHЁЃШєдкЮТЖШКЭШнЛ§ЯрЭЌЕФШ§ИіУмБеШнЦїжаЃЌАДВЛЭЌЗНЪНЭЖШыЗДгІЮяЃЌВтЕУЗДгІДяЕНЦНКтЪБЕФгаЙиЪ§ОнШчЯТБэЃК
ШнЦї | ЗДгІЮяЭЖШыСП | ЗДгІЮяЕФзЊЛЏТЪ | CH3OHЕФХЈЖШ(mol/L) | ФмСПБфЛЏ(Q1ЁЂQ2ЁЂQ3ОљДѓгк0) |
1 | 1molCOКЭ2molH2 | a1% | c1 | ЗХГіQ1KJШШСП |
2 | 1molCH3OH | a2% | c2 | ЮќЪеQ2KJШШСП |
3 | 2molCOКЭ4molH2 | a3% | c3 | ЗХГіQ3KJШШСП |
ЂйИУЗДгІЕФЁїHЮЊ_________ЃЛ(гУДјQ1ЁЂQ2ЛђQ3ЕФЪНзгБэЪО)
ЂкЯТСаЙиЯЕвЛЖЈе§ШЗЕФЪЧЃЈ______ЃЉ
A. c1= c2 B. a1 >a3 C.a1=a2 D. 2Q1 < Q3