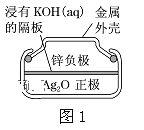
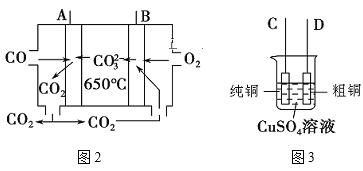
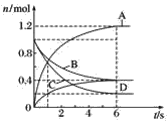
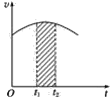
题目内容
【题目】高锰酸钾是一种重要的氧化剂,某化学实验小组制备高锰酸钾并测其纯度的步骤如下,请回答相关问题:
![]()
Ⅰ.高锰酸钾的制备
(1)将![]() 和
和![]() 固体混匀放入坩埚中,边加热边搅拌,待熔融后慢慢加入
固体混匀放入坩埚中,边加热边搅拌,待熔融后慢慢加入![]() 粉末,不断搅拌,呈颗粒状后,再加强热
粉末,不断搅拌,呈颗粒状后,再加强热![]() 得墨绿色产物(
得墨绿色产物(![]() 为墨绿色固体),冷却。
为墨绿色固体),冷却。
①制![]() 反应的化学方程式为____。
反应的化学方程式为____。
②实验中使用的坩埚及搅拌棒的材质可以是________。
A.石英 B.瓷 C.刚玉(氧化铝) D.铁
(2)取出墨绿色产物研细,每次用![]() 4%的热
4%的热![]() 溶液浸取,过滤后对滤渣重复浸取两次。合并三次浸取液,得墨绿色溶液。将墨绿色产物研细并分三次浸取,这样做的目的是_________。
溶液浸取,过滤后对滤渣重复浸取两次。合并三次浸取液,得墨绿色溶液。将墨绿色产物研细并分三次浸取,这样做的目的是_________。
(3)![]() 在水溶液中会发生歧化反应:
在水溶液中会发生歧化反应:![]() ,通入
,通入![]() 气体可促进反应趋于完全。向(2)制得的墨绿色溶液中连续通入
气体可促进反应趋于完全。向(2)制得的墨绿色溶液中连续通入![]() 气体至溶液
气体至溶液![]() 在10~11之间,过滤。滤液中的溶质除
在10~11之间,过滤。滤液中的溶质除![]() 外,还主要含有_____。
外,还主要含有_____。
(4)将滤液转入蒸发皿,小火加热,当看到________的现象时停止加热,冷却,________、________,干燥后得![]() 粗品。
粗品。

Ⅱ.高锰酸钾纯度的测定
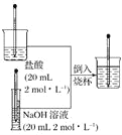
(5)称取![]() 粗品,加入煮沸并冷却后的稀硫酸配成
粗品,加入煮沸并冷却后的稀硫酸配成![]() 溶液。量取
溶液。量取![]() 的草酸(
的草酸(![]() )溶液于锥形瓶中,用所配
)溶液于锥形瓶中,用所配![]() 溶液进行滴定。重复滴定两次,平均消耗
溶液进行滴定。重复滴定两次,平均消耗![]() 溶液的体积为
溶液的体积为![]() 。
。
①滴定开始时,溶液颜色褪去较慢,随后加快,原因是________。
②滴定终点的标志是___________。
③![]() 纯度(质量分数)的计算式为________。
纯度(质量分数)的计算式为________。
【答案】![]() D 提高
D 提高![]() 的浸取率
的浸取率 ![]() 和
和![]() 液面出现晶膜 过滤 洗涤 产物
液面出现晶膜 过滤 洗涤 产物![]() 对反应本身有催化作用 最后一滴
对反应本身有催化作用 最后一滴![]() 溶液加入时,溶液由无色变为粉红色,且
溶液加入时,溶液由无色变为粉红色,且![]() 内不褪色
内不褪色 ![]()
【解析】
(1)①![]() 、
、![]() 、
、![]() 加强热生成
加强热生成![]() ,根据氧化还原反应的原理书写反应的化学方程式;②石英的主要成分为二氧化硅、陶瓷中含有二氧化硅和硅酸盐,根据二氧化硅、氧化铝、铁的性质分析判断;
,根据氧化还原反应的原理书写反应的化学方程式;②石英的主要成分为二氧化硅、陶瓷中含有二氧化硅和硅酸盐,根据二氧化硅、氧化铝、铁的性质分析判断;
(2)将墨绿色产物研细分三次浸取,可以提高物质的浸取率,据此分析解答;
(3) 二氧化碳与氢氧化钾反应生成碳酸钾,结合平衡的移动分析解答;
(4)根据蒸发结晶的基本操作分析解答;
(5)反应的原理为2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O,据此分析解答。
(1)①![]() 和
和![]() 固体混匀放入坩埚中,边加热边搅拌,待熔融后慢慢加入
固体混匀放入坩埚中,边加热边搅拌,待熔融后慢慢加入![]() 粉末,不断搅拌,加强热
粉末,不断搅拌,加强热![]() 得墨绿色产物
得墨绿色产物![]() ,根据氧化还原反应的原理,生成
,根据氧化还原反应的原理,生成![]() 的化学方程式为
的化学方程式为![]() ,故答案为:
,故答案为:![]() ;
;
②A.石英能够与KOH反应被腐蚀,故A错误;B.陶瓷中含有二氧化硅和硅酸盐,二氧化硅能够与KOH反应被腐蚀,故B错误;C.刚玉(氧化铝)能够与KOH反应被腐蚀,故C错误;D.铁与KOH等不反应,可以用铁质的坩埚及搅拌棒进行实验,故D正确;故答案为:D;
(2)将墨绿色产物研细分三次浸取,可以提高![]() 的浸取率,故答案为:提高
的浸取率,故答案为:提高![]() 的浸取率;
的浸取率;
(3)![]() 在水溶液中会发生歧化反应:
在水溶液中会发生歧化反应:![]() ,通入
,通入![]() 气体,二氧化碳与氢氧化钾反应生成碳酸钾,使得溶液中的KOH的浓度减小,平衡正向移动,可促进反应趋于完全。向
气体,二氧化碳与氢氧化钾反应生成碳酸钾,使得溶液中的KOH的浓度减小,平衡正向移动,可促进反应趋于完全。向![]() 溶液中连续通入
溶液中连续通入![]() 气体至溶液
气体至溶液![]() 在10~11之间,过滤。根据上述方程式,滤液中的溶质除
在10~11之间,过滤。根据上述方程式,滤液中的溶质除![]() 外,还主要含有
外,还主要含有![]() 和
和![]() ,故答案为:
,故答案为:![]() 和
和![]() ;
;
(4)将滤液转入蒸发皿,小火加热蒸发,当看到液面出现晶膜时停止加热,利用余热蒸干,冷却,过滤出晶体、洗涤除去晶体表面的杂质,干燥后得![]() 粗品,故答案为:液面出现晶膜;过滤;洗涤;
粗品,故答案为:液面出现晶膜;过滤;洗涤;
(5)①滴定开始时,溶液颜色褪去较慢,随后加快,可能是生成的![]() 对反应起到催化作用,故答案为:产物
对反应起到催化作用,故答案为:产物![]() 对反应本身有催化作用;
对反应本身有催化作用;
②![]() 溶液为紫红色,与草酸反应后褪色,当最后一滴
溶液为紫红色,与草酸反应后褪色,当最后一滴![]() 溶液加入时,溶液由无色变为粉红色,且
溶液加入时,溶液由无色变为粉红色,且![]() 内不褪色,表示达到了滴定终点,故答案为:最后一滴
内不褪色,表示达到了滴定终点,故答案为:最后一滴![]() 溶液加入时,溶液由无色变为粉红色,且
溶液加入时,溶液由无色变为粉红色,且![]() 内不褪色;
内不褪色;
③根据2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O可知,2![]() ~5H2C2O4,
~5H2C2O4,![]() 的草酸(
的草酸(![]() )溶液中含有草酸的物质的量为
)溶液中含有草酸的物质的量为![]() ,滴定消耗的
,滴定消耗的![]() 的物质的量为
的物质的量为![]() ×
×![]() ,因此
,因此![]() 粗品中
粗品中![]() 的纯度=
的纯度=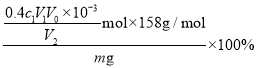 =
=![]() ,故答案为:
,故答案为:![]() 。
。

【题目】一种从含Br-废水中提取Br2的过程,包括过滤、氧化、正十二烷萃取及蒸馏等步骤。已知:
Br2 | CCl4 | 正十二烷 | |
密度/g·cm-3 | 3.119 | 1.595 | 0.753 |
沸点/℃ | 58.76 | 76.8 | 215~217 |
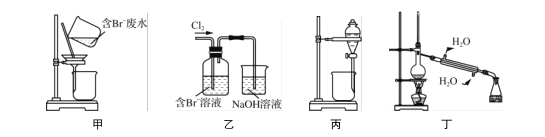
下列说法正确的是( )
A. 用甲装置过滤时,需不断搅拌
B. 用乙装置将Br-氧化为Br2
C. 丙装置中用正十二烷而不用CCl4,是因为其密度小
D. 可用装置丁进行蒸馏,先收集正十二烷再收集Br2