题目内容
【题目】氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl(-1)和S(+6)的速率v(纵坐标)与反应时间t(横坐标)的关系如图所示,已知这个反应速率随着溶液中c(H+)增大而加快。
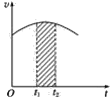
(1)反应开始时反应速率加快的原因是______________。
(2)反应后期反应速率下降的原因是______________。
(3)若纵坐标表示的是某一反应物的单位时间内的浓度变化,图中阴影部分的“面积”表示______。
【答案】溶液中c(H+)增大,化学反应速率加快 H2SO4和NaHSO3之间反应使H+及HSO3—-浓度减小,化学反应速率减慢 t1~t2段时某一反应物浓度的减小值
【解析】
(1)开始时反应速率加快,下列因素能引起溶液中反应速率加快①增加浓度,②增压,③升温,④加正催化剂。联系题意可排除②④,由于题意中不涉及热量变化,故不需考虑③;接下来考虑①,但题中无外加物,所以只考虑c(H+)的变化,KClO3→Cl-,NaHSO3→SO32-+H++Na+,c(H+)增大,反应速率v增大;
(2)氢离子浓度增大,速率加快,则氢离子浓度减小,速率会减慢,亚硫酸氢钠会消耗生成的氢离子,故反应速率又减慢了;
(3) 若纵坐标表示的是某一反应物的单位时间内的浓度变化,图中阴影部分的“面积”表示:t1~t2段时某一反应物浓度的减小值;
(1)2KClO3+6NaHSO3=3Na2SO4+2KCl+3H2SO4溶液中c(H+)增大,化学反应速率加快,
故答案为:溶液中c(H+)增大,化学反应速率加快;
(2)反应后期反应速率下降的原因是:氢离子浓度增大,速率加快,则氢离子浓度减小,速率会减慢, H2SO4和NaHSO3之间反应使H+及HSO3—-浓度减小,化学反应速率减慢,
故答案为:H2SO4和NaHSO3之间反应使H+及HSO3—-浓度减小,化学反应速率减慢;
(3)若纵坐标表示的是某一反应物的单位时间内的浓度变化,图中阴影部分的“面积”表示:t1~t2段时某一反应物浓度的减小值,
故答案为:t1~t2段时某一反应物浓度的减小值;

【题目】一定温度下,向3个初始体积均为1.0 L的密闭容器中按下表所示投料,发生反应N2(g)+3H2(g)![]() 2NH3(g) △H<0达到平衡,下列说法错误的是
2NH3(g) △H<0达到平衡,下列说法错误的是
容器编号 | 容器类型 | 起始物质的量/mol | 反应物的转化率 | 平衡时NH3的物质的量/mol | ||
N2 | H2 | NH3 | ||||
Ⅰ | 恒温恒容 | 1 | 3 | 0 | α1 | 1.2 |
Ⅱ | 绝热恒容 | 1 | 3 | 0 | α2 | a |
Ⅲ | 恒温恒压 | 2 | 6 | 0 | α3 | b |
A. 达到平衡时,α1>α2
B. 平衡时NH3的物质的量b<2.4
C. 达到平衡时,容器Ⅱ中的反应速率比容器Ⅰ中的大
D. 保持温度不变,向容器Ⅰ中再充入0.1mol N2、0.2mol H2、0.2 mol NH3,平衡向正反应方向移动