题目内容
20.用NA表示阿伏加德罗常数的值,下列说法正确的是( )| A. | 标准状况下,22.4L水含有NA个H2O分子 | |
| B. | 1mol.L-1 Na2CO3溶液中含有Na+数目为2NA | |
| C. | 常温常压下,22.4LO2中含有2NA个氧原子 | |
| D. | 16g O2 和O3的混合气体中含氧原子数目为NA |
分析 A、标况下,水为液态;
B、溶液体积不明确;
C、常温常压下,气体摩尔体积大于22.4L/mol;
D、氧气和臭氧均由氧原子构成.
解答 解:A、标况下,水为液态,不能根据气体摩尔体积来计算其物质的量,故A错误;
B、溶液体积不明确,故溶液中的钠离子的个数无法计算,故B错误;
C、常温常压下,气体摩尔体积大于22.4L/mol,故22.4L氧气的物质的量小于1mol,则含有的氧原子的个数小于2NA个,故C错误;
D、氧气和臭氧均由氧原子构成,故16g混合物中含有的氧原子的物质的量n=$\frac{16g}{16g/mol}$=1mol,故个数为NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
10.在一定温度下,向a L密闭容器中加入1mol H2(g)和1mol Br2(g),发生如下反应:H2(g)+Br2(g)?2HBr(g),此反应达到平衡的标志是( )
| A. | 容器内颜色不随时间变化 | |
| B. | 容器内H2、Br2、HBr的浓度之比为1:1:2 | |
| C. | 容器内压强不随时间变化 | |
| D. | 单位时间内消耗n mol H2,同时消耗2n mol HBr |
8.某学生将一氯丙烷和NaOH溶液共热煮沸几分钟后,冷却,立即滴入AgNO3溶液,结果未见到白色沉淀生成,其主要原因是( )
| A. | 加热时间太短,未水解 | B. | 不应该冷却 | ||
| C. | 加AgNO3溶液后未加稀HNO3 | D. | 加AgNO3溶液前未用稀HNO3酸化 |
15.下列关于物质的检验说法正确的是( )
| A. | 加入氯化钡溶液有白色沉淀生成,再加稀硝酸,沉淀不消失,一定有硫酸根离子 | |
| B. | 用四氯化碳萃取某溶液时,分层且下层显紫红色,可能存在碘单质 | |
| C. | 加入AgNO3溶液,有白色沉淀生成,证明含有Cl- | |
| D. | 加入盐酸,放出能使澄清的石灰水变浑浊的无色无味的气体,证明一定含有CO32- |
12.下列物质都属于盐的一组是( )
| A. | Na2SO4、KNO3、H2SO4 | B. | NaOH、Ba(NO3)2、CaO | ||
| C. | NaNO3、H2O、Ca(OH)2 | D. | KCl、CuSO4、Ca(NO3)2 |
9. 目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究.已知在不同温度下的化学平衡常数(K1、K2、K3)如表所示:
目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究.已知在不同温度下的化学平衡常数(K1、K2、K3)如表所示:
请回答下列问题:
(l)反应②是吸热(填“吸热”或“放热”)反应.
(2)根据反应①与②可推导出K1、K2和K3之间的关系,则K3=K1•K2(用K1、K2表示);根据反应③判断△S<(填“>”、“=”或“<”) 0,在较低(填“较高”或“较低”)温度下有利于该反应自发进行.
(3)500℃时,测得反应③在某时刻,CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度分别为0,.1mol•L-1、0.8mol•L-1、0.3mol•L-1、0.15mol•L-1,则此时v正>(填“>”、“=”或“<”) v逆.
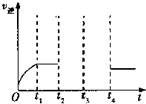
(4)某兴趣小组研究反应②的逆反应速率在下列不同条件下随时间的变化曲线,开始时升温时,t2时降压,t3时增加CO浓度,t4时又达到平衡.请画出t2至t4的曲线.
 目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究.已知在不同温度下的化学平衡常数(K1、K2、K3)如表所示:
目前工业上可利用CO或CO2来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行探究.已知在不同温度下的化学平衡常数(K1、K2、K3)如表所示:| 化学反应 | 焓变 | 平衡常数 | 温度/℃ | ||
| 500 | 700 | 800 | |||
| ①2H2(g)+CO(g)?CH3OH(g) | △H1 | K1 | 2.5 | 0.34 | 0.15 |
| ②CO2(g)+H2(g)?CO(g)+H2O(g) | △H2 | K2 | 1.0 | 1.70 | 2.52 |
| ③CO2(g)+3H2(g)?CH3OH(g)+H2O(g) | △H3 | K3 | |||
(l)反应②是吸热(填“吸热”或“放热”)反应.
(2)根据反应①与②可推导出K1、K2和K3之间的关系,则K3=K1•K2(用K1、K2表示);根据反应③判断△S<(填“>”、“=”或“<”) 0,在较低(填“较高”或“较低”)温度下有利于该反应自发进行.
(3)500℃时,测得反应③在某时刻,CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度分别为0,.1mol•L-1、0.8mol•L-1、0.3mol•L-1、0.15mol•L-1,则此时v正>(填“>”、“=”或“<”) v逆.
(4)某兴趣小组研究反应②的逆反应速率在下列不同条件下随时间的变化曲线,开始时升温时,t2时降压,t3时增加CO浓度,t4时又达到平衡.请画出t2至t4的曲线.
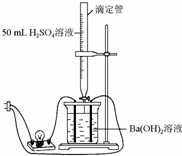 为证实Ba(OH)2溶液和H2SO4溶液的反应是离子反应,实验设计和实验过程如下:
为证实Ba(OH)2溶液和H2SO4溶液的反应是离子反应,实验设计和实验过程如下: