题目内容
已知Fe(NO3)2受热分解产物为金属氧化物、NO2和O2,请完成表格内容并回答相关问题:
(1)对固体产物中Fe化合价的猜想:
猜想一:只显+2价 猜想二:只显+3价;猜想三: 。
(2)为证明猜想二通过完成下表加以验证。供选试剂有: 0.01 mol/L 酸性KMnO4溶液、0.1 mol/L H2SO4溶液、3%H2O2溶液、0.1 mol/LKSCN溶液、蒸馏水。(仪器自添)
| 实验操作 | 现象 | 目的或结论 |
| 步骤1:取适量上述热分解后的固体于试管中,加入0.1 mol/L H2SO4溶液使其充分溶解,将上层清液分加到A、B两支试管中 | | 溶解固体产物 |
| 步骤2: | | 溶液中含有Fe3+ |
| 步骤3: | | 溶液中不含 Fe2+ |
经验证,猜想二正确,请写出Fe(NO3)2热分解的化学方程式 。
(3)某同学将带火星的木条伸入该分解反应产生的气体中,木条复燃,由此他得出“NO2能支持燃烧的结论”。请你判断该结论是否正确?并说明理由。
⑴既有+2价又有+3价(2分)不写“+”号或写成“2+”、“3+”、“Fe2+”、“Fe3+”等,不给分。
⑵实验操作 现象 步骤2:向A试管中滴入几滴0.1mol/LKSCN溶液 溶液呈血红色 步骤3:向B试管中滴入几滴0.01mol/L酸性KMnO4溶液 酸性KMnO4溶液不褪色
每空2分。
操作部分:所用试剂须从“供选试剂”中选用,否则不给分。“KSCN”、“KMnO4”化学式写错,不给分。若操作部分错误,则现象部分答案不论对错均不给分。
现象部分:“血红色”可写为“红色”,写成“砖红色”、“红褐色”、“血红色沉淀”等,不给分。“褪”字写错扣1分。
4Fe(NO3)2 2Fe2O3+8NO2↑+O2↑(2分)化学式错,不得分;配平及条件错,扣1分。
2Fe2O3+8NO2↑+O2↑(2分)化学式错,不得分;配平及条件错,扣1分。
⑶结论正确。(1分)
Fe(NO3)2分解后的气体产物中,NO2和O2的体积比为8:1,O2的体积分数小于空气中氧气的体积分数21%,若NO2不支持燃烧,则木条不会复燃。(2分)
能说明该反应产生的气体中氧气浓度较低,若NO2不支持燃烧,则木条不会复燃即可。
解析试题分析:从铁的硝酸盐分解,用氧化还原角度来看,N(+5→+2),O(-2→0),故铁的化合价可能变也可能不变,故为+2或+3价,然后据此进行探究。根据+2和+3价铁离子的检验设计实验方案,得出相关的结论。对于NO2能否支持燃烧的结论,要从,O2的百分含量的角度定量进行考虑。
考点:以探究为基础,考查了氧化还原反应、物质的检验以及探究的基本方法。

草酸亚铁(FeC2O4)常用作分析试剂、显影剂以及新型电池材料磷酸亚铁锂的生产。草酸亚铁在隔绝空气时加热能够分解,兴趣小组对草酸亚铁的分解产物进行了实验和探究。(已知:CO能与氯化钯[PdC12]溶液反应生成黑色的钯粉。)
(1)将草酸亚铁分解的气体产物依次通过澄清石灰水和氯化钯溶液,观察到澄清石灰水变浑浊,氯化钯溶液中有黑色物质生成。说明气体产物中有 。(填化学式)
(2)探究草酸亚铁分解得到的黑色固体产物中铁元素的存在形式。
【发现问题】
草酸亚铁分解后得到的黑色物质是什么?
【提出假设】
猜想1: ;猜想2:FeO;猜想3:FeO和Fe的混合物。
【实验方案】
限选试剂:盐酸、氯水、CuSO4溶液、KSCN溶液、蒸馏水。
| 实验步骤 | 实验现象 | 实验结论 |
| 步骤1:向试管中加入少量固体产物,再加入足量 ,充分振荡。 | 若溶液颜色明显改变, 且有红色固体生成。 | 有Fe存在。 |
| 步骤2:将步骤1中得到的浊液过滤,并用蒸馏水将固体洗涤至洗涤液呈无色。 | | |
| 步骤3:取步骤2得到的少量固体于试管中,滴加过量盐酸,静置后取上层清液, 。 | 。 | 有FeO存在。 |
【反思提升】
经兴趣小组讨论分析认为:草酸亚铁直接分解所得固体产物应该是FeO,而最终固体产物中还含有Fe是因为 (写化学方程式)。
(3)根据实验探究和反思,写出草酸亚铁在隔绝空气时加热直接分解的化学方程式 。
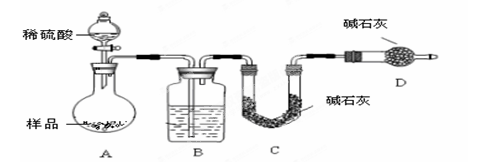
某校化学兴趣小组为探究铁与浓硫酸的反应,设计了图1、图2所示装置进行实验。 
(1)能说明有SO2气体产生的实验现象是 。
(2)图2中导气管e的主要作用为 。
(3)上述装置中图2中的NaOH溶液能吸收SO2尾气,防止污染,如将其更换为酸性KMnO4溶液,同样可以达到目的,试写出酸性KMnO4溶液与SO2反应的化学方程式:
。
(4)对比两套实验装置,不难发现图2装置除了能更好的吸收有毒气体SO2防止其污染环境外,还有一个非常明显的优点,你认为是 。
(5)反应一段时间后停止反应,待冷却后用胶头滴管吸取A试管中的溶液滴入到适量水中作为试样,试样中所含金属离子的成分有以下三种可能:
Ⅰ:只含有Fe3+;Ⅱ:只含有Fe2+; Ⅲ:既有Fe3+又有Fe2+。
为确认溶液的成分,选用如下试剂:
| A.稀HCl溶液 | B.稀硫酸 | C.KSCN溶液 | D.酸性KMnO4溶液 |
试完成下列相关的实验探究:
| 实验步骤 | 实验现象及结论 |
| 1、取一支洁净的试管,滴加1-2mL的试样溶液,再向试管中滴加几滴KSCN溶液 | (1) ,则说明Ⅱ成立。 (2) ,则说明溶液中存在Fe3+,则Ⅰ或Ⅲ成立。 |
| 2、 | 。 |
CuSO4是一种重要的化工原料,有关制备途径及性质如下图所示。下列说法错误的是( )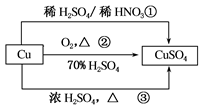
| A.途径①所用混酸中H2SO4与HNO3的最佳物质的量之比为3:2 |
| B.与途径①、③相比,途径②更好地体现了绿色化学思想 |
| C.生成等量的硫酸铜,三个途径中参加反应的硫酸的物质的量①=②<③ |
| D.利用途径②制备16g硫酸铜,被还原的硫酸的物质的量为0.1mol |
下列关于碳族元素的说法中,错误的是
| A.它们从上到下的非金属性向金属性递变的趋势比卤族元素明显 |
| B.碳族元素的气态氢化物的稳定性从上到下逐渐减弱 |
| C.碳族元素原子的最外层都有4个电子 |
| D.主要化合价有+2价和+4价,大多数+2价化合物稳定 |



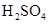 和
和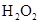 混合液的离子方程式: 。
混合液的离子方程式: 。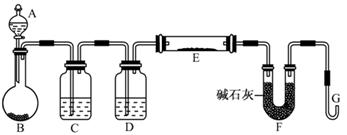

 2Al2O3+9SO2,该反应的氧化剂是_______。若生成l molAl2O3,则转移的电子数为__________________。
2Al2O3+9SO2,该反应的氧化剂是_______。若生成l molAl2O3,则转移的电子数为__________________。