题目内容
15.下列关于元素电负性大小的比较中,不正确的是( )| A. | O<S<Se<Te | B. | C<N<O<F | C. | P<S<O<F | D. | K<Na<Mg<Al |
分析 元素的非金属性越强,电负性越强;即同周期自左而右电负性增大;同一主族元素从上到下电负性逐渐减小.
解答 解:A、元素的非金属性越强,电负性越强,元素的非金属性:Te<Se<S<O,则电负性为Te<Se<S<O,故A错误;
B、同周期自左而右电负性增大,故电负性C<N<O<F,故B正确;
C、同一周期元素从左到右电负性逐渐增大,因此F>O、S>P,同一主族元素从上到下电负性逐渐减小,所以电负性O>S,故电负性:F>O>S>P,故C正确;
D、一般来说,元素非金属性越强电负性越小,金属性越强,电负性越小,即K<Na<Mg<Al,故D正确;
故选A.
点评 本题考查了元素周期律的应用,为高考常见题型,难度不大,可根据元素周期律的有关知识进行解答,注意基础知识的积累.

练习册系列答案
相关题目
5. 我国在反兴奋剂问题上的坚决立场是支持“人文奥运”的重要体现.某种兴奋剂的结构如图,关于它的说法正确的是( )
我国在反兴奋剂问题上的坚决立场是支持“人文奥运”的重要体现.某种兴奋剂的结构如图,关于它的说法正确的是( )
 我国在反兴奋剂问题上的坚决立场是支持“人文奥运”的重要体现.某种兴奋剂的结构如图,关于它的说法正确的是( )
我国在反兴奋剂问题上的坚决立场是支持“人文奥运”的重要体现.某种兴奋剂的结构如图,关于它的说法正确的是( )| A. | 它的化学式为C20H25O3 | |
| B. | 该化合物只能发生取代反应 | |
| C. | 从结构上看,它属于醇类 | |
| D. | 从元素组成上看,它可以在氧气中燃烧生成CO2和水 |
6.下列关于金属元素特征的叙述正确的是( )
①金属元素的原子只有还原性,离子只有氧化性;
②金属元素在化合物中一般显正价;
③金属性越强的元素相应的离子氧化性一般越弱;
④金属元素只有金属性,没有非金属性;
⑤最外层电子数越多的金属原子,金属性越强;
⑥离子化合物一定含金属元素.
①金属元素的原子只有还原性,离子只有氧化性;
②金属元素在化合物中一般显正价;
③金属性越强的元素相应的离子氧化性一般越弱;
④金属元素只有金属性,没有非金属性;
⑤最外层电子数越多的金属原子,金属性越强;
⑥离子化合物一定含金属元素.
| A. | ①②③ | B. | ②③ | C. | ①⑤⑥ | D. | 全部 |
3.某有机物其结构简式为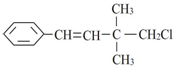 ,关于该有机物,下列叙述不正确的是( )
,关于该有机物,下列叙述不正确的是( )
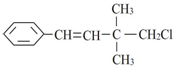 ,关于该有机物,下列叙述不正确的是( )
,关于该有机物,下列叙述不正确的是( )| A. | 所有碳原子不可能在同一平面上 | |
| B. | 属于卤代烃 | |
| C. | 分子式为C12H15Cl | |
| D. | 能发生加成反应、取代反应、加聚反应、消去反应 |
10.有机物X是一种重要的有机合成中间体,用于制造塑料、涂料和粘合剂等高聚物.为研究X的组成与结构,进行了如下实验:
(1)有机物X 的质谱图为: | (1)有机物X的相对分子质量是100. |
| (2)将10.0g X在足量O2中充分燃烧,并使其产物依次通过足量的无水CaCl2和KOH浓溶液,发现无水CaCl2增重7.2g,KOH浓溶液增重22.0g. | (2)有机物X的分子式是 C5H8O2. |
| (3)经红外光谱测定,有机物X中含有醛基;有机物X的核磁共振氢谱图上有2个吸收峰,峰面积之比是3:1. | (3)有机物X的结构简式是 (CH3)2C(CHO)2. |
20.下列化合物的沸点比较,前者低于后者的是( )
| A. | 乙醇和甲醇 | B. | 邻羟基苯甲醛与对羟基苯甲醛 | ||
| C. | 对羟基苯甲酸与邻羟基苯甲酸 | D. | H2O和H2S |
18. 模拟侯氏制碱法原理,在CaCl2浓溶液中通入NH3和CO2可制得纳米级材料,装置见图示.下列说法正确的是( )
模拟侯氏制碱法原理,在CaCl2浓溶液中通入NH3和CO2可制得纳米级材料,装置见图示.下列说法正确的是( )
 模拟侯氏制碱法原理,在CaCl2浓溶液中通入NH3和CO2可制得纳米级材料,装置见图示.下列说法正确的是( )
模拟侯氏制碱法原理,在CaCl2浓溶液中通入NH3和CO2可制得纳米级材料,装置见图示.下列说法正确的是( )| A. | a通入适量的CO2,b通入足量的NH3,纳米材料为Ca(HCO3)2 | |
| B. | a通入足量的NH3,b通入适量的CO2,纳米材料为Ca(HCO3)2 | |
| C. | a通入适量的CO2,b通入足量的NH3,纳米材料为CaCO3 | |
| D. | a通入少量的NH3,b通入足量的CO2,纳米材料为CaCO3 |
