题目内容
(1 5分)
世界环保联盟建议全面禁止使用氯气用于饮用水的消毒,而建议采用高效“绿色”消毒剂二氧化氯。二氧化氯是一种极易爆炸的强氧化性气体,易溶于水、不稳定、呈黄绿色,在生产和使用时必须尽量用稀有气体进行稀释,同时需要避免光照、震动或受热。实验室以电解法制备ClO2的流程如下: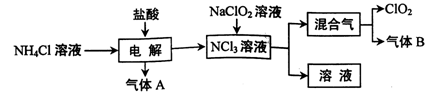
(1)ClO2中所有原子 (填“是”或“不是”)都满足8电子结构。上图所示方法制得的混合气中杂质气体B能使石蕊试液显蓝色,除去该杂质气体可选用 __;
A.饱和食盐水 B.碱石灰 C.浓硫酸 D.蒸馏水
(2)稳定性二氧化氯是为推广二氧化氯而开发的新型产品。下列说法正确的是 ;
A.二氧化氯可广泛用于工业和饮用水处理
B.应用在食品工业中能有效地延长食品贮藏期
C.稳定性二氧化氯的出现大大增加了二氧化氯的使用范围
D.在工作区和成品储藏室内,要有通风装置和监测及警报装置
(3)欧洲国家主要采用氯酸钠氧化浓盐酸制备,但该方法缺点是产率低、产品难以分离,还可能污染环境。写出该方法发生的化学方程式 ;
(4)我国广泛采用经干燥空气稀释的氯气与固体亚氯酸钠(NaClO2)反应制备,化学方程式是
,此法相比欧洲方法的优点是 。
(5)科学家又研究出了一种新的制备方法,利用硫酸酸化的草酸(H2C2O4)溶液还原氯酸钠,化学反应方程式为 ,此法提高了生产及储存、运输的安全性,原因是____ 。
(1)不是; C;(2)A、B、C、D ;(3)2NaClO3+4HCl(浓) === 2NaCl+Cl2↑+2ClO2↑+2H2O ;
(4)2NaClO2+Cl2 ="==" 2NaCl+2ClO2 ; 产率高,易于分离,没有产生毒副产品 ;
(5)H2C2O4+2NaClO3+H2SO4="==" Na2SO4+2CO2↑+2ClO2↑+2H2O ;
反应过程中生成的二氧化碳起到稀释作用
解析试题分析:(1)ClO2中所有原子不是都满足8电子的稳定结构;上图所示方法制得的混合气中杂质气体B能使石蕊试液显蓝色,则B是氨气,由于其水溶液显碱性,所以除去该杂质气体可选用酸性除杂试剂浓硫酸来除去,选项是C。(2)A.根据题意可知:二氧化氯可广泛用于工业和饮用水处理,正确;B.由于该物质有强氧化性,可以起到杀菌、消毒的作用,所以应用在食品工业中能有效地延长食品贮藏期,正确;C.由于二氧化氯是一种极易爆炸的强氧化性气体,所以稳定性大大影响其使用范围,因此稳定性二氧化氯的出现大大增加了二氧化氯的使用范围,正确;D.由于二氧化氯是一种极易爆炸的强氧化性气体,不稳定、呈黄绿色,在生产和使用时必须尽量用稀有气体进行稀释,同时需要避免光照、震动或受热。在工作区和成品储藏室内,要有通风装置和监测及警报装置,正确;(3)欧洲国家主要采用氯酸钠氧化浓盐酸制备,该反应的方程式是:2NaClO3+4HCl(浓) === 2NaCl+Cl2↑+2ClO2↑+2H2O;(4)我国广泛采用经干燥空气稀释的氯气与固体亚氯酸钠(NaClO2)反应制备,化学方程式是2NaClO2+Cl2 ="==" 2NaCl+2ClO2 ;此法相比欧洲方法的优点是产率高,易于分离,没有产生毒副产品;(5)科学家又研究出了一种新的制备方法,利用硫酸酸化的草酸(H2C2O4)溶液还原氯酸钠,化学反应方程式为H2C2O4+2NaClO3+H2SO4="==" Na2SO4+2CO2↑+2ClO2↑+2H2O ;此法提高了生产及储存、运输的安全性,原因是反应过程中生成的二氧化碳起到稀释作用。
考点:考查ClO2的结构、性质及制取方法的知识。

 名校课堂系列答案
名校课堂系列答案已知NaCN溶液呈碱性;(CN)2与卤素单质的性质相似;CN-的还原性介于Br-、I-之间。下列变化不能发生的是
A.HCN H++CN- H++CN- | B.(CN)2 + CH2=CH2→ NC—CH2—CH2—CN |
| C.(CN)2+2Br-→ 2CN-+Br2 | D.(CN)2 + 2OH-→CN- + CNO- + H2O |
已知R有多种化合价,其最高正价为+7价。在一定条件下,RO3-与R-可发生反应:RO3-+5R-+6H+=3R2+3H2O,下列关于R元素的叙述中,正确的是( )
| A.元素R位于周期表中第VA族 |
| B.RO3-中的R只能被还原 |
| C.R-离子的最外层电子数为8 |
| D.若1 mol RO3-参与该反应,则转移的电子的物质的量为5mol |
下列对化学反应的认识中,错误的是( )
| A.会引起化学键的变化 | B.会产生新的物质 |
| C.必然引起物质状态的变化 | D.必然伴随着能量的变化 |
(15分)在航天发射时,肼(N2H4)及其衍生物常用作火箭推进剂。
⑴液态肼作火箭燃料时,与液态N2O4混合发生氧化还原反应,已知每1g肼充分反应后生成气态水放出热量为a KJ,试写出该反应的热化学方程式 。
⑵实验室用N2H4·H2O与NaOH颗粒一起蒸馏,收集114~116℃的馏分即为无水肼。
①在蒸馏过程中不需要的仪器是 (填序号字母)。
| A.酒精灯 | B.长直玻璃导管 | C.锥形瓶 | D.直型冷凝管 |
②除上述必需的仪器外,还缺少的主要玻璃仪器是 。
⑶肼能使锅炉内壁的铁锈变成较为致密的磁性氧化铁(Fe3O4)层,以减缓锅炉锈蚀。若反应过程中肼转化为氮气,则每生成1molFe3O4,需要消耗肼的质量为 g。
⑷磁性氧化铁(Fe3O4)的组成可写成FeO·Fe2O3。某化学实验小组通过实验来探究一黑色粉末是否由Fe3O4、CuO组成(不含有其它黑色物质)。探究过程如下:
提出假设:假设1. 黑色粉末是CuO;假设2. 黑色粉末是Fe3O4;
假设3. 。
探究实验:
取少量粉末放入足量稀硫酸中,在所得溶液中滴加KSCN试剂。
①若假设1成立,则实验现象是 。
②若所得溶液显血红色,则假设 成立。
③为进一步探究,继续向所得溶液加入足量铁粉,若产生 现象,则假设3成立。
有另一小组同学提出,若混合物中CuO含量较少,可能加入铁粉后实验现象不明显。查阅资料:Cu2+与足量氨水反应生成深蓝色溶液,Cu2++4NH3·H2O=Cu(NH3)42++4H2O。
④为探究是假设2还是假设3成立,另取少量粉末加稀硫酸充分溶解后,再加入足量氨水,若假设2成立,则产生 现象;若产生 现象,则假设3成立。
 +I2===S4O
+I2===S4O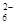 +2I-)
+2I-)

 R ②R+H2O→NaOH+Y ③Q+NaOH→V+W+H2O ④X
R ②R+H2O→NaOH+Y ③Q+NaOH→V+W+H2O ④X W+Y
W+Y Q+Z+H2O。其中M、Q、Y是单质,Q、Y在常温、常压下为气体,Z是硫酸盐,钠、钾化合物性质相似。
Q+Z+H2O。其中M、Q、Y是单质,Q、Y在常温、常压下为气体,Z是硫酸盐,钠、钾化合物性质相似。