题目内容
【题目】脱硝通常指将烟气中的氮氧化物(NOx)转化为无害的物质。
(1)选择性催化还原技术(SCR)是目前最成熟的烟气脱硝技术,即在金属催化剂作用下,用还原剂(如NH3)选择性地与NOx反应生成N2和H2O。
①已知:4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g) △H=-905.5kJ mol-1
4NO(g)+6H2O(g) △H=-905.5kJ mol-1
N2(g)+O2(g)![]() 2NO(g) △H=+180kJ mol-1
2NO(g) △H=+180kJ mol-1
完成该方法中主要反应的热化学方程式:
4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g) △H=____________。
4N2(g)+6H2O(g) △H=____________。
该方法应控制反应温度在315~400℃之间,反应温度不宜过低也不宜过高的原因是_________________。
②氨氮比[![]() ]会直接影响该方法的脱硝率,350℃时,只改变氨气的投放量,反应物X的转化率与氨氮比的关系如左下图所示,则X是______________(填化学式)。氨氮比由0.5增加到1.0时,脱硝主要反应的平衡将向_____________方向移动。当
]会直接影响该方法的脱硝率,350℃时,只改变氨气的投放量,反应物X的转化率与氨氮比的关系如左下图所示,则X是______________(填化学式)。氨氮比由0.5增加到1.0时,脱硝主要反应的平衡将向_____________方向移动。当![]() >1.0时,烟气中NO浓度反而增大,主要原因是__________________。
>1.0时,烟气中NO浓度反而增大,主要原因是__________________。
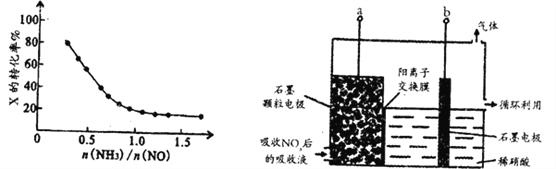
(2)直接电解吸收也是脱硝的一种方法,用6%的稀硝酸吸收NOx生成HNO2(—元弱酸),再将吸收液导入电解槽电解,使之转化为硝酸。电解装置如右上图所示。
①图中b应连接电源的_____________(填“正极”或“负极”)。
②阳极的电极反应式为________________。
【答案】 -1625.5kJ·mol-1 温度过低,反应速率小;温度过高,使脱硝主要反应的平衡向逆反应方向移动,脱硝率降低 NH3 正反应 过量氨气与氧气反应生成NO 负极 H2O+HNO2-2e=NO3-+3H+
【解析】(1)①已知:①4NH3(g)+5O2(g)4NO(g)+6H2O(g)△H=-905.5kJmol-1,②N2(g)+O2(g)2NO(g)△H=+180kJmol-1,根据盖斯定律①-②×4可得:4NH3(g)+4NO(g)+O2(g)4N2(g)+6H2O(g)△H=(-905.5kJmol-1)-(+180kJmol-1)×4=-1625.5kJ/mol;故答案为:-1625.5kJ/mol;
②该方法应控制反应温度在315~400℃之间,反应温度不宜过低也不宜过高,温度越高反应速率越快,温度过低,反应速率小,温度过高,使脱硝的主要反应的平衡向逆方向移动,脱硝率降低;故答案为:温度过低,反应速率小,温度过高,使脱硝的主要反应的平衡向逆方向移动,脱硝率降低;
③氨氮比[![]() ]越大,则氨气的物质的量越大,氨气的转化率越小,由图可知,随着氨气的浓度的增大,X的转化率减小,所以X为NH3;氨氮比增大,即氨气的浓度增大,平衡正向移动,所以氨氮比由0.5增加到1.0时,脱硝主要反应的平衡将向正反应方向移动;当
]越大,则氨气的物质的量越大,氨气的转化率越小,由图可知,随着氨气的浓度的增大,X的转化率减小,所以X为NH3;氨氮比增大,即氨气的浓度增大,平衡正向移动,所以氨氮比由0.5增加到1.0时,脱硝主要反应的平衡将向正反应方向移动;当![]() >1.0时,氨气与氧气的反应生成NO,所以烟气中NO浓度增大;故答案为:NH3;正反应;过量氨气与氧气反应生成NO;
>1.0时,氨气与氧气的反应生成NO,所以烟气中NO浓度增大;故答案为:NH3;正反应;过量氨气与氧气反应生成NO;
(2)①a电极上亚硝酸失电子生成硝酸,b电极上氢离子得电子生成氢气,所以a为阳极,b为阴极,则b与电源的负极相连;故答案为:负极;
②阳极上亚硝酸失电子生成硝酸,其电极方程式为:H2O+HNO2-2e-=NO3-+3H+;故答案为:H2O+HNO2-2e-=NO3-+3H+。

 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案【题目】已知1 g氢气完全燃烧生成液态水时放出热量143kJ, 18g水蒸气变成液态水放出44kJ的热量。其他相关数据如下表:
O=O | H-H | H-O(g) | |
1mol化学键断裂需要吸收的能量/kJ | 496 | 436 | x |
则表中x为
A. 188 B. 463 C. 557 D. 920
