题目内容
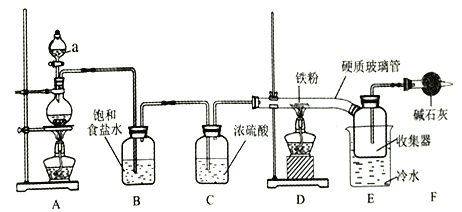
【题目】实验室验证钠能与二氧化碳发生反应,并确定其产物的装置如图所示(已知:PdC12溶液遇CO能产生黑色的Pd),下列说法错误的是

A. 装置①的仪器还可以制取H2、NH3等气体
B. 装置⑤中石灰水变浑浊后,再点燃酒精灯
C. 装置②③中分别盛装饱和Na2CO3溶液、浓H2SO4
D. 装置⑥中有黑色沉淀,发生的反应是PdC12+CO+H2O=Pd↓+CO2+2HC1
【答案】C
【解析】固体和液体不加热反应制备气体,锌和稀硫酸反应制氢气,氧化钙和浓氨水反应制备氨气都可以用装置①,A正确;金属钠与空气中的氧气、水蒸气等发生反应,因此实验之前,用二氧化碳气体排出装置内的空气,当看到装置⑤中石灰水变浑浊后,空气已排净,再点燃酒精灯,B正确;反应产生的二氧化碳气体含有氯化氢和水蒸气,因此先用饱和碳酸氢钠溶液除去氯化氢,(因为碳酸钠溶液与二氧化碳反应),再用浓H2SO4吸收水蒸气,C错误;根据题给信息可知,PdC12被CO还原为黑色的Pd,反应PdC12+CO+H2O=Pd↓+CO2+2HC1,D正确;正确选项C。

 寒假学与练系列答案
寒假学与练系列答案【题目】已知 25℃时部分弱电解质的电离平衡常数数据如表:
化学式 | HSCN | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.3×10﹣1 | 1.8×10﹣5 | Ka1=4.3×10﹣1Ka2=5.6×10﹣1 | 3.0×10﹣8 |
回答下列问题:
(1)写出碳酸的主要的电离方程式 . 若将碳酸饱和溶液稀释 10 倍,则稀释后的溶液中 c(H+)原来的十分之一(填“大于”、“小于”或“等于”).
(2)物质的量浓度均为 0.1mol/L 的五种溶液:pH 由小到大的顺序为(用编号填写).
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3 e.NaSCN
(3)25℃时,将 20mL0.1molL﹣1CH COOH 溶液和 20mL0.1molL﹣1HSCN 溶液分别与 20mL0.1molL﹣1NaHCO 溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图.
反应初始阶段两种溶液产生 CO2气体的速率存在明显差异的原因是反应结束后,假设 NaHCO3完全反应且气体全部逸出,则所得两溶液中,c(CH3COO)c(SCN)(填“>”、“<”或“=”)
(4)25℃时,CH3COONa 与 CH3COOH 的混合溶液,若测得 pH=8,则溶液中c(Na+)﹣c(CH3COO﹣)=mol/L(填代入数据后的计算式,不必算出具体数值).
(5)向 NaClO 溶液中通入少量的 CO2 , 发生反应的离子方程式为 .
【题目】在2L密闭容器内,800℃时反应2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.006 | 0.006 | 0.006 |
(1)上述反应在第5s时NO的转化率是___________。用O2表示从0~2s内该反应的平均速率V(O2)=__________。
(2)下图中表示NO2的变化的曲线是__________。

(3)能使该反应的反应速率增大的是__________。
A.及时分离出NO2气体 B.适当升高温度 C.增大O2的浓度 D.选择高效催化剂
(4)能说明该反应已达到平衡状态的是___________。
A.v(NO2)=2v(O2) B.容器内压强保持不变
C.v逆(NO)=2v正(O2) D.容器内质量保持不变