题目内容
【题目】某研究性学习小组设计了一组实验来探究元素周期律。甲同学设计了如图装置,根据元素非金属性与对应最高价含氧酸之间的关系,可以一次性完成碳族元素中C与Si的非金属性强弱比较的实验研究;乙同学设计了如图装置来验证卤族元素性质的递变规律。A、B、C三处分别是蘸有NaBr溶液的棉花、湿润的淀粉KI试纸、蘸有碱液的棉花。已知常温下浓盐酸与高锰酸钾能反应生成氯气。
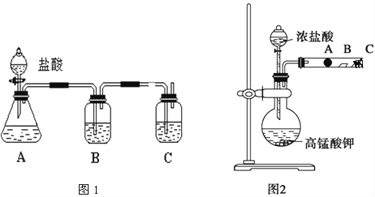
(1)甲同学设计实验的理论依据是_____________________________________;
写出选用药品分别为:A____________,B__________,C____________;
其中装置B中所盛试剂的作用为_____________________________________;
C中反应的离子方程式为____________________________________________;
(2)乙同学的实验理论依据是______________________________________;
A处的现象是: ___________________________________________;
写出B处的离子方程式_____________,C处药品的作用 ____________________。
【答案】 最高价氧化物对应水化合物酸性H2CO3>H2SiO3 CaCO3 饱和NaHCO3溶液 Na2SiO3溶液 除去CO2气体中混有的HCl气体 CO2+H2O+SiO32-===H2SiO3↓+CO32- 非金属性强的元素对应的单质可置换出非金属性弱的元素对应的单质 棉花变成橙黄色 Cl2+2I-====2Cl-+I2 吸收尾气
【解析】本题考查实验方案设计与评价,(1)甲同学设计目的是比较碳和硅非金属性的强弱,利用理论是非金属性越强,其最高价氧化物的水化物酸性越强;先制备CO2,实验室制备CO2,用碳酸钙与盐酸的反应,A中盛放碳酸钙或碳酸盐或碳酸氢盐,因为盐酸易挥发,CO2中混有HCl,对后续实验产生干扰,因此需要除去,因此装置B盛放饱和碳酸氢钠溶液,装置C中盛放硅酸钠溶液;根据上述分析,装置B的作用是除去CO2中混有HCl;(2)乙同学设计实验的目的是验证卤素性质的递变规律,原理利用置换反应,氧化剂的氧化性大于氧化产物的氧化性;烧瓶中产生氯气,A为蘸有NaBr溶液的棉花,发生Cl2+2Br-=2Cl-+Br2,因此A中出现的现象是棉花变成橙黄色;B处的反应是Cl2+2I-=2Cl-+I2;氯气有毒,污染空气,因此C的作用是除去未反应的氯气。

