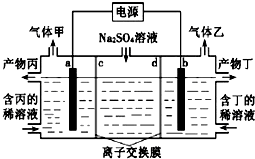
��Ŀ����
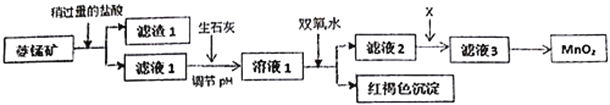
����Ŀ����ҵ�������̿�MnCO3���ۺ�FeCO3��SiO2��Cu2(OH)2CO3�����ʣ�Ϊԭ����ȡ�������̣�������ʾ��ͼ���£�
��֪�������������������pH
Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
��ʼ����ʱ | 8.3 | 6.3 | 2.7 | 4.7 |
��ȫ����ʱ | 9.8 | 8.3 | 3.7 | 6.7 |
Ksp(CuS)=6.3��10-16 Ksp(MnS)= 3��10-14
ע���������ӵ���ʼŨ��Ϊ0.1 mol/L
�ش��������⣺
��1�������ʵ����̿�ʹ��ǰ�轫����飬��ҪĿ����_________________________������1�ijɷ���_________�������ܽ�MnCO3�����ӷ���ʽ��_________________________________��
��2������ʯ�Ҷ�����NaOH����pH��ԭ����_______________________________��
��3����Һ2�м���ij������X���Գ�ȥCu2+�����ʺϵ���_______________��
A.MnO2 B.NaOH C.MnS
�÷�Ӧ�����ӷ���ʽ��____________________________��
��4����MnCl2ת��ΪMnO2��һ�ַ����ǽ��ữ��NaClO3��Һ����Mn2+���벹�䲢��ƽ���з��̣�____Mn2++_____ClO3-+______��____Cl2��+____MnO2+_________��_________________
��5����MnCl2ת��ΪMnO2����һ�ַ����ǵ�ⷨ�����������������������������������
�� MnO2�ڵ��ص�__________________������������������������������������ɣ�
�� ��ֱ�ӵ��MnCl2��Һ������MnO2��ͬʱ���������Cl2������Cl2�IJ�����_______________��
���𰸡� ����Ӧ��Ӵ��������߷�Ӧ���� SiO2 MnCO3+2H+=Mn2++CO2��+H2O ��ʯ�Ҿ���ʵ�� C MnS+Cu2+��Mn2++CuS 5 2 4H2O 1 5 8H+ ���� ����ʪ�ĵ��۵⻯����ֽ������������������ֽ������֤����Cl2����
��������������Ҫ���������ȡ�������̹������̵����ۡ�
��1�������ʵ����̿�ʹ��ǰ�轫����飬��ҪĿ��������Ӧ��Ӵ��������߷�Ӧ���ʡ�����1�ijɷ��Dz����������SiO2�������ܽ�MnCO3�����ӷ���ʽ��MnCO3+2H+=Mn2++CO2��+H2O��
��2������ʯ�Ҷ�����NaOH����pH��ԭ������ʯ�Ҿ���ʵ����
��3����Һ2�м���ij������X���Գ�ȥCu2+�����ʺϵ���C����A.��Ч��B.������������Na+��C.���ʣ���ѡC���÷�Ӧ�����ӷ���ʽ��MnS+Cu2+��Mn2++CuS��
��4�����ݵ����غ����������ʽ��ƽΪ5Mn2++2ClO3-+______��Cl2��+5MnO2+_________�� �ٸ��ݵ���غ��Ԫ���غ����������ʽ��5Mn2++2ClO3-+4H2O ��Cl2��+5MnO2+8H+��
��5����MnO2����������ڵ��ص��������ɣ�
������Cl2�IJ����ǽ���ʪ�ĵ��۵⻯����ֽ������������������ֽ������֤����Cl2���ɡ�

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�