题目内容
17.现要配制0.01mol/L的KMnO4溶液,下列操作导致所配溶液浓度偏高的是( )| A. | 称量时,使用了游码,但砝码和药品放颠倒了 | |
| B. | 定容时俯视容量瓶刻度线 | |
| C. | 原容量瓶洗净后没有干燥 | |
| D. | 摇匀后见液面下降,再加水至刻度线 |
分析 根据c=$\frac{n}{V}$并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析.
解答 解:A、称量时,使用了游码,但砝码和药品放颠倒了,则会导致所称量的药品的质量偏少,则浓度偏低,故A错误;
B、定容时俯视刻度线,则溶液体积偏小,则浓度偏高,故B正确;
C、容量瓶洗净后没有干燥,对溶液浓度无影响,故C错误;
D、摇匀后液面下降是正常的,再加水则溶液浓度偏低,故D错误.
故选B.
点评 本题考查了一定物质的量浓度溶液的配制过程中的误差分析,属于基础型题目,难度不大.

练习册系列答案
相关题目
12.恒温、恒容的条件下对于N2(g)+3H2(g)?2NH3(g)△H<0的反应,达到化学平衡状态的标志为( )
| A. | 混合气体的平均相对分子质量不变 | |
| B. | 混合气体的密度不变 | |
| C. | 断开一个N≡N键的同时有6个N-H键生成 | |
| D. | N2、H2、NH3分子数之比为1:3:2的状态 |
2.在电解水制取H2和O2时,为了增强溶液的导电性,常常要加入一些电解质,最好选用下列物质中的( )
| A. | HCl | B. | Na2SO4 | C. | CuSO4 | D. | NaCl |
9.下列两种物质的溶液混合后,能发生离子反应,且溶液的总质量不会发生改变的是 ( )
| A. | 石灰水和稀盐酸混合 | |
| B. | 小苏打溶液和柠檬水混合 | |
| C. | 人工盐(含有硫酸钠、碳酸氢钠、氯化钠、硫酸钾)溶液与BaCl2溶液混合 | |
| D. | 氯化钠溶液和蔗糖水混合 |
2. 溴乙烷是一种重要的化工合成原料.实验室合成溴乙烷的反应和实验装置如下:
溴乙烷是一种重要的化工合成原料.实验室合成溴乙烷的反应和实验装置如下:
实验中可能用到的数据如表:
①合成反应:在仪器A中加入适量NaBr、1:1浓硫酸和50mL乙醇,安装好仪器,缓缓加热,收集馏出物.
②分离提纯:将馏出物加水后振荡,再加入适量酸除去乙醚,分液,最后得到52mL溴乙烷.
回答下列问题:
(1)配制体积比1:1的硫酸所用的定量仪器为b(选填编号).
a.天平 b.量筒 c.容量瓶 d.滴定管
(2)仪器A中发生的反应为:NaBr+H2SO4+CH3CH2CH2CH2OH→CH3CH2CH2CH2Br+NaHSO4+H2O.(用一条方程式表示)
(3)仪器B的名称是蒸馏烧瓶,冷水进口是b(填“a”或“b”).
(4)制备时,需将仪器C置于盛有冰水混合物的烧杯中,目的是冷却溴乙烷.
(5)上述装置中的仪器连接部分都为玻璃接口的原因是:反应会产生Br2,腐蚀橡胶.
(6)溴乙烷粗产品可能混有多种杂质,若仪器A中获得的有机物呈棕黄色,除去其中杂质的正确方法是d(选填编号).
a.蒸馏
b.氢氧化钠溶液洗涤
c.用四氯化碳萃取
d.用亚硫酸钠溶液洗涤
加水的目的是为了除除去溶解在溴乙烷中乙醇.
(7)该实验所得溴乙烷的产率为79%.(保留两位有效数字)
 溴乙烷是一种重要的化工合成原料.实验室合成溴乙烷的反应和实验装置如下:
溴乙烷是一种重要的化工合成原料.实验室合成溴乙烷的反应和实验装置如下:实验中可能用到的数据如表:
| 物 质 | 相对分子质量 | 沸点(℃) | 密度(g•cm-3) | 水溶性 |
| CH3CH2OH | 46 | 78.4 | 0.79 | 互溶 |
| CH3CH2Br | 109 | 38.4 | 1.42 | 难溶 |
| CH3CH2OCH2CH3 | 74 | 34.5 | 0.71 | 微溶 |
| CH2=CH2 | 28 | -103.7 | 0.38 | 不溶 |
| 浓硫酸(H2SO4) | 98 | 338.0 | 1.38 | 易溶 |
②分离提纯:将馏出物加水后振荡,再加入适量酸除去乙醚,分液,最后得到52mL溴乙烷.
回答下列问题:
(1)配制体积比1:1的硫酸所用的定量仪器为b(选填编号).
a.天平 b.量筒 c.容量瓶 d.滴定管
(2)仪器A中发生的反应为:NaBr+H2SO4+CH3CH2CH2CH2OH→CH3CH2CH2CH2Br+NaHSO4+H2O.(用一条方程式表示)
(3)仪器B的名称是蒸馏烧瓶,冷水进口是b(填“a”或“b”).
(4)制备时,需将仪器C置于盛有冰水混合物的烧杯中,目的是冷却溴乙烷.
(5)上述装置中的仪器连接部分都为玻璃接口的原因是:反应会产生Br2,腐蚀橡胶.
(6)溴乙烷粗产品可能混有多种杂质,若仪器A中获得的有机物呈棕黄色,除去其中杂质的正确方法是d(选填编号).
a.蒸馏
b.氢氧化钠溶液洗涤
c.用四氯化碳萃取
d.用亚硫酸钠溶液洗涤
加水的目的是为了除除去溶解在溴乙烷中乙醇.
(7)该实验所得溴乙烷的产率为79%.(保留两位有效数字)
 铁、铝及其化合物在生产和生活中有着广泛的应用.
铁、铝及其化合物在生产和生活中有着广泛的应用.
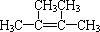
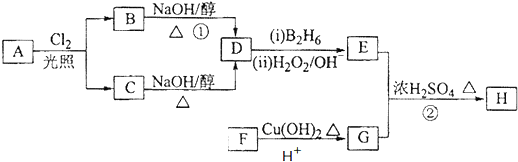
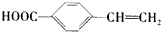
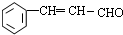 按先后顺序写出检验F中官能团的试剂Br2的CCl4溶液和银氨溶液对应反应的现象是Br2的CCl4溶液褪色和银镜生成
按先后顺序写出检验F中官能团的试剂Br2的CCl4溶液和银氨溶液对应反应的现象是Br2的CCl4溶液褪色和银镜生成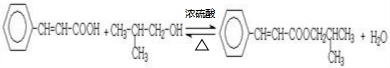 ;
;