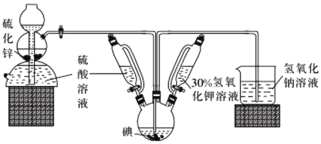
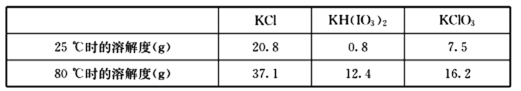
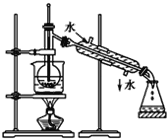
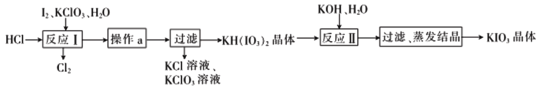题目内容
【题目】已知:常温下邻苯二甲酸H2A的Ka1=1.1×10-3,Ka2=3.9×10-6。用NaOH溶液滴定邻苯二甲酸氢钾(KHA)溶液,混合溶液的相对导电能力变化如图所示(忽略混合时溶液温度的变化),其中N点为反应终点。下列说法正确的是( )
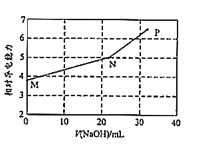
A.M点离子浓度:c(K+)>c(HA-)>c(H2A)>c(A2-)
B.N点溶液中存在:c(Na+)+c(K+)>2c(A2-)+2c(HA-)
C.P点溶液中一定存在:c(Na+)>c(K+)>c(OH-)>c(A2-)
D.从M到P之间的任一点均存在:c(Na+)+c(K+)+c(H+)=c(A2-)+c(HA-)+c(OH-)
【答案】B
【解析】
邻苯二甲酸氢钾KHA与氢氧化钠反应,HA-+OH-=A2-+H2O,到达N点后,溶液变为K2A和NaOH的混合溶液。
A. M点时,溶液为KHA,水解平衡常数Kb=![]() <Ka2,离子电离大于水解,即离子浓度:c(K+)>c(HA-)>c(A2-)>c(H2A),A错误;
<Ka2,离子电离大于水解,即离子浓度:c(K+)>c(HA-)>c(A2-)>c(H2A),A错误;
B. N点溶液为Na2A,根据电荷守恒可知,c(Na+)+c(K+)+c(H+)=2c(A2-)+2c(HA-)+c(OH-),溶液显碱性,c(H+)<c(OH-),故c(Na+)+c(K+)>2c(A2-)+2c(HA-),B正确;
C. P点氢氧化钠过量,溶液中存在:c(Na+)>c(OH-)>c(K+)>c(A2-),C错误;
D. 根据电荷守恒可知,溶液中恒存在c(Na+)+c(K+)+c(H+)=2c(A2-)+c(HA-)+c(OH-),D错误。
答案为B。

【题目】一定温度下,在三个体积均为0.5 L的恒容密闭容器中发生反应:CO(g)+Cl2(g)![]() COCl2(g),其中容器Ⅰ中反应在5 min时达到平衡状态。
COCl2(g),其中容器Ⅰ中反应在5 min时达到平衡状态。
容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | ||
CO | Cl2 | COCl2 | COCl2 | ||
Ⅰ | 500 | 1.0 | 1.0 | 0 | 0.8 |
Ⅱ | 500 | 1.0 | a | 0 | 0.5 |
Ⅲ | 600 | 0.5 | 0.5 | 0.5 | 0.7 |
下列说法中正确的是
A. 容器Ⅰ中前5 min的平均反应速率v(CO)=0.16 mol·L-1·min-1
B. 该反应正反应为吸热反应
C. 容器Ⅱ中起始时Cl2的物质的量为0.55 mol
D. 若起始时向容器Ⅰ加入CO0.8mol、Cl20.8mol,达到平衡时CO转化率大于80%