��Ŀ����
����Ŀ���ⱻ��Ϊ������Ԫ�ء�����ѧ�����ز����ɷ��ε�ȱ������KI��KIO3���Ⱥ����ڼӵ����С�KI�������ڷ����Լ����й���ϡ���ҩ�ȣ����Ʊ�ԭ�����£�
��ӦI��3I2+ 6KOH== KIO3 +5KI+ 3H2O
��ӦII��3H2S+KIO3=3S��+KI+ 3H2O
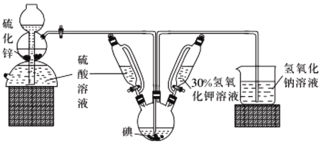
��ش��й����⡣
(1)���շ������з�����Ӧ�Ļ�ѧ����ʽΪ________��װ����ʢװ30%����������Һ������������__________��
(2)�ر����շ������������ȵ���30%��KOH��Һ.���۲쵽������ƿ����Һ��ɫ���ػ�ɫ��Ϊ______(������)��ֹͣ����KOH��Һ��Ȼ��________(�����)����������ƿ���ձ��в������ݵ����ʽӽ����ʱֹͣͨ����
(3)����������Һ������������ƿ�е���Һ����ˮԡ���ȣ���Ŀ����_______________��
(4)��������ƿ�е���Һ�����ձ��У�����̼�ᱵ���ڹ������й��ˣ����˵õ��ij����г����й���̼�ᱵ�⣬���������ᱵ��____(������)���ϲ���Һ��ϴ��Һ�������������ᾧ������ó�Ʒ��
(5)ʵ����ģ�ҵ�Ʊ�KIO3�������£�
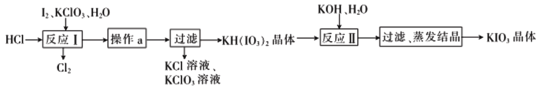
�������ʵ��ܽ�ȼ��±���

�ö��Ե缫���KI��ҺҲ���Ʊ�KIO3�����ⷨ��ȣ����������Ʊ�KIO3��ȱ����_________��
(6)ijͬѧ�ⶨ.��������������KIO3��Ʒ�Ĵ��ȡ�
ȡ1.00 g��Ʒ��������ˮ�в��������ữ���ټ��������KI�������ĵ�����Һ����εμ�2.0 mol��L-1 Na2S2O3��Һ��ǡ����ȫ��Ӧʱ������12. 60 mL Na2S2O3��Һ������Ʒ��KIO3����������Ϊ___________(��֪��Ӧ��I2+2Na2S2O3=2NaI+Na2S4O6)��
���𰸡�ZnS+H2SO4=H2S��+ZnSO4 ��ѹ��Һ©�� ��ɫ �����շ�����������ͨ������ ʹ��Һ�ữ�����ȣ���������Һ��ʣ��������ݳ����Ӷ���ȥ���� �� KClO3��I2��Ӧʱ������ж�����������Ⱦ���� 89.88%
��������
(1)���շ������з����ķ�Ӧ����п��ϡ���ᷴӦ�����������������п��
(2)������ƿ�����ȷ�����Ӧ3I2+ 6KOH= KIO3 +5KI+ 3H2O��Ȼ�������շ����������ɵ�H2S������Ӧ3H2S+KIO3=3S��+KI+ 3H2O���Ӷ��Ƶ�KI��
(1)���շ������з����ķ�Ӧ����п��ϡ���ᷴӦ�����������������п����Ӧ�Ļ�ѧ����ʽ�� ZnS+ H2SO4 =H2S��+ZnSO4������A������Ϊ��ѹ��Һ©�����ʴ�Ϊ�� ZnS+ H2SO4 =H2S��+ZnSO4����ѹ��Һ©����
(2)�ر����շ�������������Һ©���Ļ���������30%��KOH��Һ�����۲��ػ�ɫ��Һ��Ϊ��ɫ��ֹͣ����KOH��Һ��Ȼ������շ�����������ͨ�������KIO3���Һ��NaOH��Һ�������ʽӽ���ͬʱֹͣͨ�����ʴ�Ϊ����ɫ�������շ�����������ͨ�����壻
(3)����������Һ������KI���Һˮԡ���ȣ���Ŀ���ǣ�ʹ��Һ�ữ�����ȣ�������H2S������Ӷ���ȥH2S���ʴ�Ϊ��ʹ��Һ�ữ�����ȣ�������H2S������Ӷ���ȥH2S��
(4)ͨ�������KIO3���Һ��NaOH��Һ�������ʽӽ���ͬʱֹͣͨ�������з�����Ӧ3H2S+ KIO3 =3S��+KI+ 3H2O����KI���Һ�����ձ�������̼�ᱵ��ȥ���������ᣬ�ڹ������й��ˣ����˵õ��ij����г����й���̼�ᱵ�⣬�������ᱵ�͵����ʴ�Ϊ����
(5)�������̣��⡢����ء�ˮ�ữ��Ӧ�õ�KH(IO3)2��Cl2��KCl����ȥCl2���ᾧKH(IO3)2���ˣ�����KH(IO3)2��KCl����ˮ�ܽ�KH(IO3)2������KOH����pH��Ũ���ᾧ�õ�����أ���ⷨ��������Ϊ����أ���KClO3������������������Ⱦ�������ʴ�Ϊ��KClO3��I2��Ӧʱ������ж�����������Ⱦ������
(6)����Ʒ��KIO3����������Ϊx��
KIO3 + 5KI + 3H2SO4 = 3K2SO4 +3I2+3H2O�٣�I2+2S2O32-=2I- + S4O62-�ڣ�������ʽ�ڡ�3 +�ٵã�
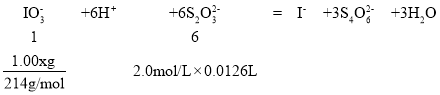
���Ե���ص���������x=![]() ���ʴ�Ϊ��89.88% ��
���ʴ�Ϊ��89.88% ��

����Ŀ��1 mol ����ϩ��![]() ���ڲ�ͬ��������H2�����ӳɷ�Ӧʱ��������ڲ��죺
���ڲ�ͬ��������H2�����ӳɷ�Ӧʱ��������ڲ��죺
���� | �������� | �ӳɲ��� | |
�� | ���¡���ѹ������ | 1 mol |
|
�� | ���¡���ѹ������ | 4 mol |
|
����˵����ȷ����
A.���������µļӳɲ��ﶼ���ڷ�����
B.���������µļӳɲ��ﶼ��ʹ���Ը��������Һ��ɫ
C.���������µļӳɲ��ﶼ���ڹ����������������ȡ��
D.������˵�������ϵ�̼̼˫���ȱ����ڵ�̼̼˫��������