题目内容
(1)AgNO3的水溶液呈______(填“酸”、“中”、“碱”)性,原因是(用离子方程式表示):______;实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的______中,然后再用蒸馏水稀释到所需的浓度.若用惰性电极电解AgNO3的水溶液,请写出电池反应的离子方程式______,
(2)常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色.在分析该溶液遇酚酞呈红色原因时,甲同学认为是配制溶液所用的纯碱样品中混有NaOH所至;乙同学认为是溶液中Na2CO3电离出的CO32-水解所至.请你设计一个简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论)____________
(3)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化
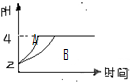
如右图所示.则图中表示醋酸溶液中pH变化曲线的是______(填“A”或“B”).设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2.则m1______m2
(选填“<”、“=”、“>”)
(4)钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一.
①钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的电极反应式为:负极:______正极:______;
②为了降低某水库的铁闸门被腐蚀的速率,可以采用图甲所示的方案,其中焊接在铁闸
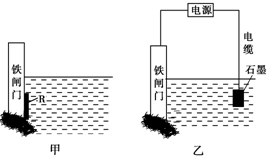
门上的固体材料R可以采用______.
A.铜 B.钠
C.锌 D.石墨
③图乙所示的方案也可以降低铁闸门的腐蚀速率,其中铁闸门应该连接在直流电源的______极.
(5)氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
①氢氧燃料电池的能量转化主要形式是______,在导线中电子流动
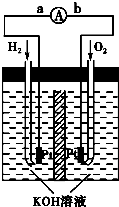
方向为______(用a、b表示).
②负极反应式为______.
③电极表面镀铂粉的原因为______.
(2)常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色.在分析该溶液遇酚酞呈红色原因时,甲同学认为是配制溶液所用的纯碱样品中混有NaOH所至;乙同学认为是溶液中Na2CO3电离出的CO32-水解所至.请你设计一个简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论)____________
(3)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化

如右图所示.则图中表示醋酸溶液中pH变化曲线的是______(填“A”或“B”).设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2.则m1______m2
(选填“<”、“=”、“>”)
(4)钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一.
①钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的电极反应式为:负极:______正极:______;
②为了降低某水库的铁闸门被腐蚀的速率,可以采用图甲所示的方案,其中焊接在铁闸

门上的固体材料R可以采用______.
A.铜 B.钠
C.锌 D.石墨
③图乙所示的方案也可以降低铁闸门的腐蚀速率,其中铁闸门应该连接在直流电源的______极.
(5)氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
①氢氧燃料电池的能量转化主要形式是______,在导线中电子流动

方向为______(用a、b表示).
②负极反应式为______.
③电极表面镀铂粉的原因为______.
(1)AgNO3为强酸弱碱盐,Ag+离子水解使溶液呈酸性,水解方程式为Ag++H2O

AgOH+H+,在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,防止Ag+离子水解使溶液溶液浑浊,惰性电极电解AgNO3的水溶液时,银离子的氧化性强于水中氢离子,所以阴极银离子放电,得电子,阴极:Ag++e-=Ag;水中氢氧根的还原性强于硝酸根,所以阳极氢氧根放电,失电子,阳极:2H20-4e-=O2+4H+,总反应:4Ag++2H2O
4Ag+O2↑+4H+,
故答案为:酸;Ag++H2O

AgOH+H+;硝酸;4Ag++2H2O
4Ag+O2↑+4H+;
(2)要验证该溶液遇酚酞呈红色原因,可用以下方法,
方法一:向红色溶液中加入足量BaCl2溶液,如果溶液显红色,说明甲正确,如果红色褪去,说明乙正确;
方法二:加热,如果红色不变说明甲正确,如果红色加深,说明乙正确,
故答案为:向红色溶液中加入足量BaCl2溶液,如果溶液还显红色说明甲正确,红色褪去说明乙正确;
(3)由于醋酸是弱电解质,与Zn反应同时,电离出H+,所以pH变化较缓慢,所以B曲线是醋酸溶液的pH变化曲线.由图知盐酸和醋酸的pH变化都是由2到4,但醋酸是边反应边电离H+,故消耗的Zn多,所以m1<m2.
故答案为:B;<;
(4)①钢铁发生吸氧腐蚀时,负极发生氧化反应,电极反应为2Fe=2Fe2++4e-,正极发生还原反应,
电极反应为O2+2H2O+4e-=4OH-,故答案为:2Fe=2Fe2++4e-,O2+2H2O+4e-=4OH-;
②为了降低某水库的铁闸门被腐蚀的速率,应将铁设计成原电池的正极,则负极为较铁更活泼的金属,选项中锌可以,但不可用钠,因钠与水发生剧烈反应,起不到保护铁不被腐蚀的效果,故答案为:C;
③图乙所示的方案为外加电源的阴极保护法,铁连接电源的负极,故答案为:负;
(5)①原电池的实质为化学能转化成电能,氢氧燃料电池总反应为2H2+O2=2H2O,其中H元素的化合价从零价升至+1价,失去电子,即电子从a流向b,故答案为:化学能转化成电能;a→b;
②负极为失去电子的一极,即H2失电子生成H+,由于溶液是碱性的,故电极反应式左右应各加上OH-,故电极反应式为2H2+4OH-=4H2O+4e-,故答案为:2H2+4OH-=4H2O+4e-;
③铂粉的接触面积大,可以加快反应速率,故答案为:增大电极单位面积吸附H2、O2分子数,加快电极反应速率.

AgOH+H+,在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,防止Ag+离子水解使溶液溶液浑浊,惰性电极电解AgNO3的水溶液时,银离子的氧化性强于水中氢离子,所以阴极银离子放电,得电子,阴极:Ag++e-=Ag;水中氢氧根的还原性强于硝酸根,所以阳极氢氧根放电,失电子,阳极:2H20-4e-=O2+4H+,总反应:4Ag++2H2O
| ||
故答案为:酸;Ag++H2O

AgOH+H+;硝酸;4Ag++2H2O
| ||
(2)要验证该溶液遇酚酞呈红色原因,可用以下方法,
方法一:向红色溶液中加入足量BaCl2溶液,如果溶液显红色,说明甲正确,如果红色褪去,说明乙正确;
方法二:加热,如果红色不变说明甲正确,如果红色加深,说明乙正确,
故答案为:向红色溶液中加入足量BaCl2溶液,如果溶液还显红色说明甲正确,红色褪去说明乙正确;
(3)由于醋酸是弱电解质,与Zn反应同时,电离出H+,所以pH变化较缓慢,所以B曲线是醋酸溶液的pH变化曲线.由图知盐酸和醋酸的pH变化都是由2到4,但醋酸是边反应边电离H+,故消耗的Zn多,所以m1<m2.
故答案为:B;<;
(4)①钢铁发生吸氧腐蚀时,负极发生氧化反应,电极反应为2Fe=2Fe2++4e-,正极发生还原反应,
电极反应为O2+2H2O+4e-=4OH-,故答案为:2Fe=2Fe2++4e-,O2+2H2O+4e-=4OH-;
②为了降低某水库的铁闸门被腐蚀的速率,应将铁设计成原电池的正极,则负极为较铁更活泼的金属,选项中锌可以,但不可用钠,因钠与水发生剧烈反应,起不到保护铁不被腐蚀的效果,故答案为:C;
③图乙所示的方案为外加电源的阴极保护法,铁连接电源的负极,故答案为:负;
(5)①原电池的实质为化学能转化成电能,氢氧燃料电池总反应为2H2+O2=2H2O,其中H元素的化合价从零价升至+1价,失去电子,即电子从a流向b,故答案为:化学能转化成电能;a→b;
②负极为失去电子的一极,即H2失电子生成H+,由于溶液是碱性的,故电极反应式左右应各加上OH-,故电极反应式为2H2+4OH-=4H2O+4e-,故答案为:2H2+4OH-=4H2O+4e-;
③铂粉的接触面积大,可以加快反应速率,故答案为:增大电极单位面积吸附H2、O2分子数,加快电极反应速率.

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案
相关题目