题目内容
【题目】“绿水青山就是金山银山”,研究NxOy、CO、SO2等大气污染物和水污染物的处理对建设美丽中国具有重要意义。
(1)已知:①NO2+CO![]() CO2+NO该反应的平衡常数为K1(下同),每1mol下列物质分解为气态基态原子吸收的能量分别为
CO2+NO该反应的平衡常数为K1(下同),每1mol下列物质分解为气态基态原子吸收的能量分别为
NO2 | CO | CO2 | NO |
812kJ | 1076kJ | 1490kJ | 632kJ |
②N2(g)+O2(g)![]() 2NO(g) △H=+179.5kJ/mol K2
2NO(g) △H=+179.5kJ/mol K2
③2NO(g)+O2(g)![]() 2NO2(g) △H=-112.3kJ/mol K3
2NO2(g) △H=-112.3kJ/mol K3
写出NO与CO反应生成无污染气体的热化学方程式_____________________,该热化学方程式的平衡常数K=______________________(用K1、K2、K3表示)
(2)直接排放含SO2的烟气会形成酸雨,危害环境。可用NaOH吸收,所得含硫各微粒(H2SO3、HSO3-和SO32-)存在于反应后的溶液中,它们的物质的量分数X与溶液pH的关系如图所示。
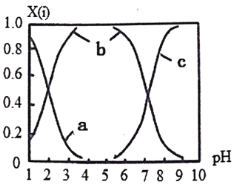
①测得溶液的pH=8时,溶液中各离子浓度由大到小的顺序是___________。
②向 NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降低,用化学平衡移动原理解释溶液pH降低的原因________________________。
(3)在一定温度下的恒容容器中,反应2N2O(g)![]() 2N2(g)+O2(g)的部分实验数据如下:
2N2(g)+O2(g)的部分实验数据如下:
反应时 间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
c(N2O) /(mol/L) | 0.100 | 0.090 | 0.080 | 0.070 | 0.060 | 0.050 | 0.040 | 0.030 | 0.020 | 0.010 | 0.000 |
①在0~40min时段,反应速率v(N2O)为___________mol/(L·min)。
②若N2O起始浓度c0为0.150 mol/L,则反应至30mn时N2O的转化率a=___________。
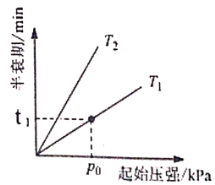
③不同温度(T)下,N2O分解半衰期随起始压强的变化关系如图所示(图中半衰期指任一浓度N2O消耗一半时所需的相应时间),则T1___________T2(填“>”、“=”或“<”)。当温度为T1、起始压强为p0,反应至t1min时,体系压强p=___________(用p0表示)
【答案】2NO(g) +2CO(g)![]() N2(g) +2CO2(g) △H =-759.8 kJ/mol K12.K3/K2 c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+) 亚硫酸氢根离子存在电离平衡HSO3-
N2(g) +2CO2(g) △H =-759.8 kJ/mol K12.K3/K2 c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+) 亚硫酸氢根离子存在电离平衡HSO3-![]() H++SO32-,加入氯化钙后,Ca2++SO32-=CaSO3↓,使电离平衡正向移动,氢离子浓度增大,pH减小。 1.0×10-3 20.0% > 1.25p0
H++SO32-,加入氯化钙后,Ca2++SO32-=CaSO3↓,使电离平衡正向移动,氢离子浓度增大,pH减小。 1.0×10-3 20.0% > 1.25p0
【解析】
(1)由已知,反应①的△H=(812+1076-1490-632)kJ/mol=-234kJ/mol,根据盖斯定律,①×2+③-②得:2NO2(g)+2CO(g)![]() N2(g)+2CO2(g),△H=[-234×2+(-112.3)-179.5]kJ/mol=-759.8kJ/mol;当总反应式相加时,平衡常数相乘,相减时平衡常数相除,成倍时平衡常数为幂,据此判断平衡常数关系;
N2(g)+2CO2(g),△H=[-234×2+(-112.3)-179.5]kJ/mol=-759.8kJ/mol;当总反应式相加时,平衡常数相乘,相减时平衡常数相除,成倍时平衡常数为幂,据此判断平衡常数关系;
(2)①由图可得,pH=8时溶液中溶质主要为Na2SO3和NaHSO3,c(SO32-)>c(HSO3-),溶液中的主要离子为:Na+、SO32-、HSO3-,次要离子为OH-、H+,据此判断离子浓度大小顺序;
②NaHSO3溶液中HSO3-存在电离平衡HSO3-![]() H++SO32-,加入氯化钙后,Ca2++SO32-=CaSO3↓,使电离平衡正向移动,氢离子浓度增大。
H++SO32-,加入氯化钙后,Ca2++SO32-=CaSO3↓,使电离平衡正向移动,氢离子浓度增大。
(3) ①V=![]() 计算;
计算;
②根据△c=V△t,然后根据转化率![]() 计算;
计算;
③根据温度升高,反应速率加快,半衰期缩短;利用表格数据计算分析。
(1)由已知,反应①的△H=(812+1076-1490-632)kJ/mol=-234kJ/mol,根据盖斯定律,①×2+③-②得:2NO2(g)+2CO(g)![]() N2(g)+2CO2(g),△H=[-234×2+(-112.3)-179.5]kJ/mol=-759.8kJ/mol,当总反应式相加时平衡常数相乘,相减时平衡常数相除,成倍时平衡常数为幂,所以平衡常数K=
N2(g)+2CO2(g),△H=[-234×2+(-112.3)-179.5]kJ/mol=-759.8kJ/mol,当总反应式相加时平衡常数相乘,相减时平衡常数相除,成倍时平衡常数为幂,所以平衡常数K=![]() ;
;
(2)①由图可得,pH=8时溶液中溶质主要为Na2SO3和NaHSO3,c(SO32-)>c(HSO3-),溶液中的主要离子为:Na+、SO32-、HSO3-,次要离子为OH-、H+,离子浓度大小顺序为c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+);
②NaHSO3溶液中HSO3-存在电离平衡HSO3-![]() H++SO32-,加入氯化钙后,Ca2++SO32-=CaSO3↓,使电离平衡正向移动,氢离子浓度增大,所以pH降低;
H++SO32-,加入氯化钙后,Ca2++SO32-=CaSO3↓,使电离平衡正向移动,氢离子浓度增大,所以pH降低;
(3)①在0~40min时段,△c=(0.100mol/L-0.060mol/L)=0.040mol/L,所以化学反应速率v(N2O)=![]() = 1.0×10-3 mol/(L·min);
= 1.0×10-3 mol/(L·min);
②根据①可知化学反应速率为1.0×10-3 mol/(L·min),则30min内改变的浓度△c=V·△t=1.0×10-3 mol/(L·min) ×30min=0.03mol/L,所以N2O的转化率![]() =20%;
=20%;
③根据温度升高,反应速率加快,半衰期时间缩短。根据图示可知在压强不变时,半衰期T1<T2,说明温度T1>T2;
根据题干信息可知2N2O(g)![]() 2N2(g)+O2(g),反应开始时c(N2O)=0.100mol/L,当其浓度减小一半时,物质的浓度:c(N2O)=0.050mol/L,c(N2)=0.050mol/L,c(O2)=0.0250mol/L,此时物质的总浓度=0.050mol/L+0.050mol/L+0.0250mol/L=0.125mol/L,起始时的浓度为0.1mol/L,所以体系压强
2N2(g)+O2(g),反应开始时c(N2O)=0.100mol/L,当其浓度减小一半时,物质的浓度:c(N2O)=0.050mol/L,c(N2)=0.050mol/L,c(O2)=0.0250mol/L,此时物质的总浓度=0.050mol/L+0.050mol/L+0.0250mol/L=0.125mol/L,起始时的浓度为0.1mol/L,所以体系压强![]() p=1.25,所以P=1.25P0。
p=1.25,所以P=1.25P0。

 名校课堂系列答案
名校课堂系列答案【题目】嫦娥三号探测器携国旗在月面探测时,要经受高低温交替变化、强辐射等恶劣环境的考验。为解决棉布(主要成分是纤维素)和丝绸(主要成分是蛋白质)等材料制作的国旗在此环境下易变色和开裂的问题,科研团队通过大量模拟实验,最终选择了某种合成聚酰亚胺作为制作国旗的基本材料,从而使鲜艳夺目的五星红旗展现在月球上!请回答下列问题:
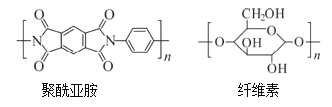
(l)从组成和结构看,如图所示的聚酰亚胺比纤维素多一种元素,该元素的符号是________;纤维素中所含的官能团除醚键(![]() )外,另一种官能团是_____________。
)外,另一种官能团是_____________。
(2)月球表面温度通常在![]() 之间交替变化。为使制作国旗的材料能适应温度巨变,科研工作者在模拟实验中,先将聚酰亚胺制作的五星红旗置于极度低温的_________(填下表中制冷剂的名称)环境中数秒,取出后马上放进________(填“略高于”或“低于”)130℃的高温恒温箱中数分钟,如此反复实验了数百次。
之间交替变化。为使制作国旗的材料能适应温度巨变,科研工作者在模拟实验中,先将聚酰亚胺制作的五星红旗置于极度低温的_________(填下表中制冷剂的名称)环境中数秒,取出后马上放进________(填“略高于”或“低于”)130℃的高温恒温箱中数分钟,如此反复实验了数百次。
制冷剂 | 干冰 | 干冰-乙醚 | 液氮 |
极限制冷温度/℃ |
|
|
|
(3)聚酰亚胺、纤维素、蛋白质均为高分子化合物,但与聚酰亚胺不同,纤维素和蛋白质都属于____(填“合成”或“天然”)高分子化合物。这三种高分子化合物在酸性条件下均可水解,其中,纤维素水解的最终产物为单糖,该单糖的名称是______(填“葡萄糖”或“果糖”);蛋白质水解的最终产物为______。
(4)随着社会发展,有机固体废弃物的数量剧增,对这类废弃物可用封闭式焚烧或卫生填埋处理。相比卫生填埋,封闭式焚烧的优点是减小废弃物的体积,同时可利用燃烧产生的热量发电,该发电过程实现了“____能→热能→机械能→电能”的转化;但这种处理方法也存在成本高、可能产生有害______(填“气体”或“液体”)污染环境的缺点。废弃塑料袋是生活中常见的有机固体废弃物,填埋、焚烧都有缺点,因此,我们有必要通过________(填一种方法)来减少这类固体废弃物的产生。