题目内容
7. 化学在环境保护中起着十分重要的作用,催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染.
化学在环境保护中起着十分重要的作用,催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染.(1)催化反硝化法中,H2能将NO3-还原为N2.25℃时,反应进行10min,溶液的pH由中性变为C(OH-)为0.01mol•L-1.
①N2的结构式为N≡N.
②上述反应的离子方程式为2NO3-+5H2=N2+2OH-+4H2O,其平均反应速率υ(NO3-)为0.001mol•L-1min-1.
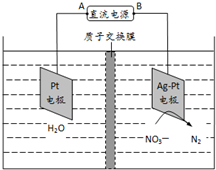
(2)电化学降解NO3-的原理如图所示.
①电源正极为A(填A或B),阴极反应式为2NO3-+12H++10e-=N2+6H2O.
②若电解过程中转移了2mol电子,则膜两侧电解液的质量变化差(△m左-△m右)为14.4g.
分析 (1)①氮气分子中氮原子间形成3个共用电子对;
②在催化剂条件下,氢气和硝酸根离子发生氧化还原反应生成氮气、水和氢氧根离子;先根据溶液pH的变化计算氢氧根离子反应速率,再根据氢氧根离子和硝酸根离子之间的关系式计算硝酸根离子反应速率;
(2)①由图示知在Ag-Pt电极上NO3-发生还原反应,因此Ag-Pt电极为阴极,则B为负极,A为电源正极;阴极反应是NO3-得电子发生还原反应生成N2,利用电荷守恒与原子守恒知有氢离子参与反应且有水生成;
②转移2mol电子时,阳极(阳极反应为H2O失电子氧化为O2和H+)消耗1mol水,产生2molH+进入阴极室,阳极室质量减少18g;阴极室中放出0.2molN2(5.6g),同时有2molH+(2g)进入阴极室.
解答 解:(1)①N2分子中氮原子间通过氮氮三键结合,因此其结构式为N≡N,故答案为:N≡N;
②利用溶液pH变化可知有OH-生成,再结合原子守恒可写出反应的离子方程式为2NO3-+5H2=N2+2OH-+4H2O,利用离子方程式知v(NO3-)=v(OH-)=$\frac{10{\;}^{-2}-10{\;}^{-7}}{10}$mol/(L•min)=0.001 mol/(L•min),
故答案为:2NO3-+5H2=N2+2OH-+4H2O;0.001;
(2)①由图示知在Ag-Pt电极上NO3-发生还原反应,因此Ag-Pt电极为阴极,则B为负极,A为电源正极;在阴极反应是NO3-得电子发生还原反应生成N2,利用电荷守恒与原子守恒知有H+参与反应且有水生成,所以阴极上发生的电极反应式为:2NO3-+12H++10e-=N2+6H2O,
故答案为:A;2NO3-+12H++10e-=N2+6H2O;
②转移2mol电子时,阳极(阳极反应为H2O失电子氧化为O2和H+)消耗1mol水,产生2molH+进入阴极室,阳极室质量减少18g;阴极室中放出0.2molN2(5.6g),同时有2molH+(2g)进入阴极室,因此阴极室质量减少3.6g,故膜两侧电解液的质量变化差(△m左-△m右)=18g-3.6g=14.4g,
故答案为:14.4.
点评 本题考查结构式和离子方程式的书写、电解原理、反应速率计算、平衡移动等知识点,(2)中②要注意该题中阴极室有氢离子进入,易漏掉,为易错点.


| A. | 该物质属于烃类 | B. | 该物质易溶于水 | ||
| C. | 该物质能使酸性高锰酸钾溶液褪色 | D. | 该物质是一种高分子化合物 |
| A. | 25℃,1.01×105 Pa,64g SO2中含有的原子数为3NA | |
| B. | 在1mol的Na2O2晶体中离子总数为3NA | |
| C. | 在0.5mol/L NaCl溶液中,含有的Na+数目为0.5NA | |
| D. | 标准状况下,11.2LH2O 含有的分子数为0.5NA |
| 化学式 | 摩尔质量/(g•mol-1) | 质量/g | 物质的量/mol | 分子或离子数 |
| H2SO4 | 4.9 | |||
| SO2 | 0.5 | |||
| OH- | 6.02×1024 | |||
| NH4+ | 6.02×1022 |
Ⅰ.甲、乙两支试管分别盛甲烷和氯气的混合气体(以体积比1:1混合),其中一支用黑纸包好,将它们置于光线一般的室内,等待片刻,观察现象.请填写下表:
| 实验现象 | 实验结论 | |
| 甲 | 在光照条件下,试管内气体颜色变浅了;试管内壁上出现了油状液滴. | CH4与Cl2在光照条件下 发生化学反应 |
| 乙 | 迅速剥开黑纸,立即观察,试管内气体颜色为黄绿色. | CH4与Cl2在无光照条件下不发生化学反应. |
Ⅱ.为探究乙烯与溴的加成反应,因实验室制得的乙烯中通常会含有少量的SO2等杂质气体,该同学认为应先除去杂质,再通入溴水中.为此,他设计了如图所示的实验装置:
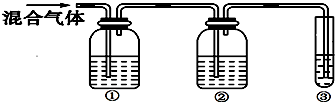
请回答:
(1)①、②、③装置中可盛放的试剂是:①A、②B、③C.(填序号)
A.NaOH溶液 B.品红 C.溴水 D.酸性高锰酸钾溶液
(2)除杂后,观察到溴水褪色,结合所学内容得出结论:乙烯可与溴水发生加成反应.请写出化学反应方程式CH2=CH2+Br2→
 .
.Ⅲ.为了探究苯与溴反应生成溴苯的实验,该同学采用下图所示装置,请分析装置并完成下列题目:

(1)关闭F夹,打开C夹,向装有少量苯的三颈烧瓶中由A口加入过量溴,再加入少量铁屑,塞住A口,则三颈烧瓶中发生反应的化学方程式为
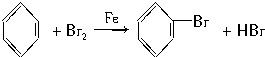
(2)D、E试管内出现的现象为石蕊溶液变红、出现淡黄色沉淀.
通过探究,该同学得出结论:甲烷、乙烯和苯在不同的条件下均能与卤素反应.
Ⅳ.现有H2、Cl2、乙烷、乙烯这四种原料,请你设计一种制取一氯乙烷的最佳实验方案,请用方程式表示出来(注意:原料不一定要全部选用).H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl、CH2=CH2+HCl$\stackrel{催化剂}{→}$CH3CH2Cl.
| A. | c(NH4+)相等的(NH4)2SO4溶液、NH4HSO4溶液和NH4Cl溶液中,溶质浓度大小关系是:c[(NH4)2SO4]<c[(NH4HSO4]<c(NH4Cl) | |
| B. | 欲除去CuCl2溶液中混有少量的FeCl3,可加入CuO | |
| C. | 0.2mol/L HCl溶液与等体积0.05mol/L Ba(OH)2溶液混合后,溶液的pH=1 | |
| D. | 0.2mol/L的NaHCO3溶液中c(H+)+c(H2CO3)=c(CO32-)+c(OH-) |
| A. | 混合气体的体积恒定不变 | |
| B. | 混合气体的颜色不再改变 | |
| C. | 混合气体的平均摩尔质量不变 | |
| D. | I2在混合气体中的体积分数与H2在混合气体中的体积分数相等 |

 .
.