题目内容
6.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )| A. | 25℃,1.01×105 Pa,64g SO2中含有的原子数为3NA | |
| B. | 在1mol的Na2O2晶体中离子总数为3NA | |
| C. | 在0.5mol/L NaCl溶液中,含有的Na+数目为0.5NA | |
| D. | 标准状况下,11.2LH2O 含有的分子数为0.5NA |
分析 A、求出二氧化硫的物质的量,然后根据1mol二氧化硫中含3mol原子来分析;
B、过氧化钠由2个钠离子和1个过氧根构成;
C、溶液体积不明确;
D、标况下,水为液体.
解答 解:A、64g二氧化硫的物质的量n=$\frac{64g}{64g/mol}$=1mol,而1mol二氧化硫中含3mol原子即3NA个,故A正确;
B、过氧化钠由2个钠离子和1个过氧根构成;,故1mol过氧化钠中含3mol离子即3NA个,故B正确;
C、溶液体积不明确,故溶液中的钠离子的个数无法计算,故C错误;
D、标况下,水为液体,不能根据气体摩尔体积来计算水的物质的量,故D错误.
故选AB.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,熟练掌握公式的运用和物质的结构是解题关键.

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目
16.如图所示的实验,能达到实验目的是( )

| A. | 实验①制取的氨气溶解在饱和NaCl溶液 | |
| B. | 实验②通过观察右边试管有无倒吸现象说明铁钉是否发生吸氧腐蚀 | |
| C. | 实验③可用于证明碳的非金属性比硅强 | |
| D. | 图④是实验室洗涤胶头滴管的操作 |
17.运用推理、归纳、类比、对比的方法得出下列结论,其中合理的是( )
| A. | 铝的金属活动性比铁强,则铝制品比铁制品更易锈蚀 | |
| B. | 水和过氧化氢的组成元素相同,则二者的化学性质相同 | |
| C. | Na+、Mg2+、Cl-的最外层电子数均为8,由此得出离子的最外层电子数均为8 | |
| D. | 同温下分解氯酸钾,加催化剂的反应速率更快,说明催化剂可以改变反应速率 |
14.某有机物的结构简式如图所示,有关该有机物的叙述正确的是( )


| A. | 分子中含有3 种官能团 | |
| B. | 在一定条件下,能发生取代、氧化、酯化和加聚反应 | |
| C. | 该物质分子中最多可以有10 个碳原子在同一平面上 | |
| D. | 1 mol 该物质最多可与5 mol H2发生加成反应 |
1.若m g氢气含n个氢分子,则阿伏加德罗常数为( )
| A. | 2n | B. | $\frac{n}{m}$ | C. | $\frac{2n}{m}$ | D. | n |
11.下列说法不正确的是( )
| A. | 分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA | |
| B. | 常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA | |
| C. | 18g H2O含有10NA个质子 | |
| D. | 1mol K2SO4中阴离子所带电荷数为NA |
18.常温下,下列离子组在pH=1的溶液中不能大量共存的是( )
| A. | Al3+、Na+、NO3-、Cl- | B. | Fe3+、Na+、C1-、NO3- | ||
| C. | K+、NH4+、Cl-、AlO2- | D. | Cu2+、NH4+、SO42-、NO3- |
8.分子组成为C4H9OH并能发生催化氧化反应但不能得到醛的有机化合物有( )
| A. | 4种 | B. | 3种 | C. | 2种 | D. | 1种 |
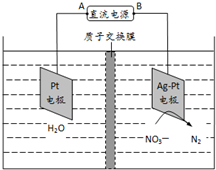 化学在环境保护中起着十分重要的作用,催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染.
化学在环境保护中起着十分重要的作用,催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染.