题目内容
19.NA为阿伏伽德罗常数.下列说法正确的是( )| A. | 25℃时pH=13的NaOH溶液中含有OH-的数目为0.1NA | |
| B. | 常温常压下,8gO2含有4NA个电子 | |
| C. | 标准状况下,2024L乙醇含有0.1nA个CH3CH2OH分子 | |
| D. | KIO3+6HI=KI+3H2O+3I2,生产3molI2转移电子的总数为5NA |
分析 A、溶液体积不明确;
B、求出氧原子的物质的量,然后根据1mol氧原子中含8mol电子来分析;
C、标况下乙醇为液态;
D、此反应转移5mol电子,生成3mol碘单质.
解答 解:A、溶液体积不明确,故溶液中的氢氧根的个数无法计算,故A错误;
B、8g氧气中含有的氧原子的物质的量n=$\frac{8g}{16g/mol}$=0.5mol,而1mol氧原子中含8mol电子,故0.5mol氧原子中含4mol电子即4NA个,故B正确;
C、标况下乙醇为液态,故不能根据气体摩尔体积来计算其物质的量,故C错误;
D、此反应转移5mol电子,生成3mol碘单质,故当生成3mol碘单质时转移5mol电子即5NA个,故D正确.
故选BD.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
9.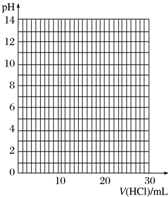 某校化学兴趣小组的同学对一含有少量Na2SO4的NaOH样品中NaOH的含量进行测定.请回答下列问题:
某校化学兴趣小组的同学对一含有少量Na2SO4的NaOH样品中NaOH的含量进行测定.请回答下列问题:
(1)甲同学运用沉淀法测定样品中NaOH的含量.该同学选用的药品除样品外,还应有氯化钡溶液;实验中应测定的数据有样品质量和沉淀的质量.
(2)乙同学运用滴定法测定样品中NaOH的含量.
①用分析天平称取该样品5.000g,全部溶于水配制成1 000.0mL溶液.用碱式滴定管量取20.00mL所配溶液放在锥形瓶中,滴加几滴指示剂,待测.滴定管在使用前除洗涤外,还应检漏、润洗.
②用浓度为0.100 0mol•L-1的盐酸标准溶液进行滴定.开始滴定前的一步操作是调节液面于“0”刻度或“0”刻度以下.
③滴定过程中用pH计测定锥形瓶中溶液的pH,临近滴定终点时测定pH应每滴一滴测一次.
④滴定过程中,锥形瓶中溶液的pH变化如下:
请在坐标图中绘制出上述中和滴定的曲线.
⑤如上表所示是几种酸碱指示剂的变色范围,根据你所作的中和滴定曲线分析,上述中和滴定中应选用的指示剂是甲基橙或酚酞.
⑥样品中,NaOH的质量百分含量为96%.
(3)以下滴定操作能导致最终滴定结果偏低的是ADF
A.碱式滴定管取液前尖嘴处有气泡,取液后气泡消失
B.滴定结束后,仰视读取酸式滴定管的数据
C.锥形瓶内盛装待测液之前有少量蒸馏水
D.滴定时,锥形瓶在摇动过程中有液体飞溅出来
E.酸式滴定管使用前未润洗
F.碱式滴定管使用前未润洗.
 某校化学兴趣小组的同学对一含有少量Na2SO4的NaOH样品中NaOH的含量进行测定.请回答下列问题:
某校化学兴趣小组的同学对一含有少量Na2SO4的NaOH样品中NaOH的含量进行测定.请回答下列问题:(1)甲同学运用沉淀法测定样品中NaOH的含量.该同学选用的药品除样品外,还应有氯化钡溶液;实验中应测定的数据有样品质量和沉淀的质量.
(2)乙同学运用滴定法测定样品中NaOH的含量.
①用分析天平称取该样品5.000g,全部溶于水配制成1 000.0mL溶液.用碱式滴定管量取20.00mL所配溶液放在锥形瓶中,滴加几滴指示剂,待测.滴定管在使用前除洗涤外,还应检漏、润洗.
②用浓度为0.100 0mol•L-1的盐酸标准溶液进行滴定.开始滴定前的一步操作是调节液面于“0”刻度或“0”刻度以下.
③滴定过程中用pH计测定锥形瓶中溶液的pH,临近滴定终点时测定pH应每滴一滴测一次.
④滴定过程中,锥形瓶中溶液的pH变化如下:
| V(HCl)/mL | 0.00 | 12.00 | 18.00 | 22.00 | 23.00 | 23.96 | 24.00 | 24.04 | 25.00 | 26.00 | 30.00 |
| pH | 13.1 | 12.6 | 12.2 | 11.7 | 11.4 | 9.9 | 7.0 | 4.0 | 2.7 | 2.4 | 1.9 |
| 指示剂 | 变色范围(pH) | 颜色 | |
| 酸 | 碱 | ||
| 甲基橙 | 3.1~4.4 | 红 | 黄 |
| 石蕊 | 5.0~8.0 | 红 | 蓝 |
| 酚酞 | 8.2~10.0 | 无 | 红 |
⑥样品中,NaOH的质量百分含量为96%.
(3)以下滴定操作能导致最终滴定结果偏低的是ADF
A.碱式滴定管取液前尖嘴处有气泡,取液后气泡消失
B.滴定结束后,仰视读取酸式滴定管的数据
C.锥形瓶内盛装待测液之前有少量蒸馏水
D.滴定时,锥形瓶在摇动过程中有液体飞溅出来
E.酸式滴定管使用前未润洗
F.碱式滴定管使用前未润洗.
10.用NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A. | 0.5mol锌粒与足量盐酸反应产生11.2L H2 | |
| B. | 标准状况下,11.2L H2O所含分子数为0.5NA | |
| C. | 0.5mol•L-1的MgCl2溶液中含有Cl-个数为NA | |
| D. | 25℃、101Pa时,16g O2和O3混合气体中含有的原子数为NA |
7.下列元素属于第IA族的是( )
| A. | 硅 | B. | 碘 | C. | 硼 | D. | 铯 |
14.下列关于NaCl的说法不正确的是( )
| A. | 给NaCl溶液通电,使NaCl发生电离 | |
| B. | NaCl是电解质 | |
| C. | NaCl的电离方程式是:NaCl═Na++Cl- | |
| D. | NaCl溶液能导电,是因为溶液中有自由移动的离子 |
2.某高分子化合物的结构简式如下则其单体的名称为( )
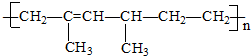

| A. | 2,4-二甲基-2-已烯 | B. | 2,4-二甲基-1,3-已二烯 | ||
| C. | 乙烯和2-甲基-1,3-戊二烯 | D. | 烯和2-甲基-1,3-丁二烯 |
9.NA表示阿伏加德罗常数,以下说法正确的是( )
| A. | 31 g白磷含有P-P键的总数为6 NA | |
| B. | 1.6 g NH2?离子含有电子总数为NA | |
| C. | 1 L1 mol•L-1FeCl3溶液中含有Fe3+的数目为NA | |
| D. | 标准状况,22.4 L NO和 22.4 L O2的混合气体所含分子数为1.5NA |
6.某含铬(Cr2O72-)废水用硫酸亚铁铵[FeSO4•(NH4)2SO4•6H2O]处理,反应中铁元素和铬元素完全转化为沉淀.该沉淀经干燥后得到nmolFeO•FeyCrxO3.不考虑处理过程中的实际损耗,下列叙述正确的是( )
| A. | 处理废水中的Cr2O72-的物质的量为nx | |
| B. | 反应中发生转移的电子数为6nxmol | |
| C. | 在FeO•FeyCrxO3中,y=3x=$\frac{3}{2}$ | |
| D. | 消耗硫酸亚铁的物质的量为n(2-x) |