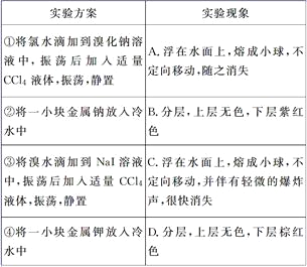
题目内容
【题目】标准状况下将4.48 L CO2通入1 L 0.6 mol.L-l NaOH溶液中,当CO2与NaOH完全反应时,下列说法不正确的是
A.反应后的溶液不能确定是否能继续吸收CO2B.溶液中溶质的物质的量之比为1:1
C.反应后的溶液呈碱性D.溶液中不只有一种阴离子
【答案】A
【解析】
反应的可能方程式有:CO2+2NaOH=Na2CO3+H2O,CO2+NaOH=NaHCO3,n(CO2)= ![]() =0.2mol,n(NaOH)=1L×0.6mol/L=0.6mol,则有
=0.2mol,n(NaOH)=1L×0.6mol/L=0.6mol,则有 =3>2,所以:所得产物为Na2CO3和NaOH,溶液中存在的主要阴离子有CO32、OH-,据此分析解答。
=3>2,所以:所得产物为Na2CO3和NaOH,溶液中存在的主要阴离子有CO32、OH-,据此分析解答。
A. 根据以上分析,反应的溶液中有Na2CO3和NaOH,Na2CO3+CO2+H2O=2NaHCO3,还能吸收少量CO2,故A错误;
B. n(CO2)= ![]() =0.2mol,n(NaOH)=1L×0.6mol/L=0.6mol,根据化学方程式CO2+2NaOH=Na2CO3+H2O,则氢氧化钠过量,二氧化碳的物质的量为0.2mol,生成碳酸钠的物质的量为0.2mol,二氧化碳与氢氧化钠是按照1:2的关系反应的,反应掉的氢氧化钠为0.4mol,剩余了0.6mol-0.4mol=0.2mol,溶液中溶质的物质的量之比为1:1,故B正确;
=0.2mol,n(NaOH)=1L×0.6mol/L=0.6mol,根据化学方程式CO2+2NaOH=Na2CO3+H2O,则氢氧化钠过量,二氧化碳的物质的量为0.2mol,生成碳酸钠的物质的量为0.2mol,二氧化碳与氢氧化钠是按照1:2的关系反应的,反应掉的氢氧化钠为0.4mol,剩余了0.6mol-0.4mol=0.2mol,溶液中溶质的物质的量之比为1:1,故B正确;
C. 反应后的溶液为Na2CO3和NaOH,呈碱性,故C正确;
D. 溶液中存在的主要阴离子有CO32、OH-,故D正确;
答案选A。

 名校课堂系列答案
名校课堂系列答案【题目】用钛铁矿(主要含FeTiO3及Fe2O3、SiO2等不溶性杂质)提取高品位TiO2的一种流程如下图所示。

回答下列问题:
(1)有关钛的说法正确的是_________(填字母序号)。
A.TiOSO4中钛元素的化合价为+4价 |
B.TiO2中既含有离子键,又含有共价键 |
C.钛元素位于元素周期表中IVA族 |
D.在稀有气体氩氛围和800℃条件下,用金属镁与四氯化钛反应可制取金属钛。 |
反应的化学方程式为![]()
(2)为了从浸取液中获取纯净的FeSO4·7H2O,II中应采取的操作是_________、_________、过滤、洗涤、干燥。如何检验提取FeSO4·7H2O的溶液中存在Fe2+_________。
(3)III中生成H2TiO3的离子方程式是__________________。
(4)将TiO2与焦炭混合,通入氯气在1173K下反应,然后将生成的TiCl4与CO分离可制取TiCl4。 此反应中,氧化剂与还原剂物质的量之比是___________。TiCl4极易水解,利用此性质又可制备纳米级二氧化钛TiO2·XH2O,该反应的化学方程式是__________________。
(5)将TiO2熔于NaF 制成熔融盐,以石墨为阴极、覆盖了氧渗透膜的多孔金属陶瓷涂层为阳极,用如图所示电解装置制取金属钛。阳极电极反应式是__________________

【题目】某化学小组用50ml 0.50mol/L NaOH溶液和30ml 0.50mol/L硫酸溶液进行中和热的测定实验。
(1)实验中大约要使用230mL NaOH溶液,配制溶液时至少需要称量NaOH固体__ g。
(2)做中和热的测定实验时:桌上备有大、小两个烧杯、泡沫塑料、硬纸板、胶头滴管、环形玻璃搅拌棒.实验尚缺少的玻璃仪器(用品)是______、______。
(3)他们记录的实验数据如下:
①请填写表中的空白:
实验次数 | 起始温度t1 | 终止温度t2/℃ | 温度差平均值(t2﹣t1)/℃ | |
H2SO4 | NaOH | |||
1 | 25.0℃ | 25.0℃ | 29.1 | Δt=________ |
2 | 25.0℃ | 25.0℃ | 29.8 | |
3 | 25.0℃ | 25.0℃ | 28.9 | |
4 | 25.0℃ | 25.0℃ | 29.0 | |
②已知:溶液的比热容c为4.18 J·℃-1·g-1,溶液的密度均为1 g·cm-3。写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式____________(用该实验的数据,取小数点后一位)。
(4)若用氨水代替NaOH做实验,测定结果ΔH会___(填“偏大”、“偏大”、“无影响”)。
【题目】芜湖市某便利店销售的一种食用碘盐包装袋上有如下标签:
产品标准 | GB5461 |
产品等级 | 一级 |
配料 | 食盐、碘酸钾、抗结剂 |
碘含量(以I计) | 20~50mg/kg |
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,请配平化学方程式:____KIO3+____KI+____H2SO4=____K2SO4+_____I2+____H2O
(2)实验室可分离获取单质碘,其实验操作可分解为如下几步:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.把适量碘水和CCl4加入分液漏斗中,并盖好玻璃塞;
C.检验分液漏斗活塞和上口玻璃塞是否漏液;
D.倒转漏斗,用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
E.旋开活塞,用烧杯接收下层溶液;
F.从分液漏斗的上口倒出上层水溶液;
G.将漏斗上口的玻璃塞打开;
H.静置、分层;
①正确的操作顺序是(用编号字母填写)____→____ → ___→A → __→ ___→E→F。
②下列物质,不能作为从水溶液中萃取碘的溶剂是____。
A.苯 B.汽油 C.酒精
(3)若向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。理论上Na2SO3与I2反应的物质的量之比为____。