题目内容
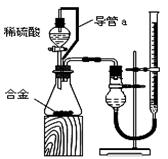
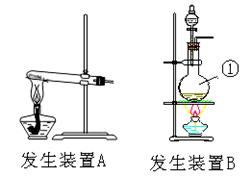
(6分)根据正放在桌面上的右图装置,回答下列问题:

(1)现有H2、SO2、NH3、N2 四种气体
①用排空气法收集某气体,则由A口进气可收集到的气体为 。
②用排水法收集某气体,可在该容器中充满水,气体应由 口进入。
(2)若用该装置除去H2中的水分,容器中可盛放的试剂为 。

(1)现有H2、SO2、NH3、N2 四种气体
①用排空气法收集某气体,则由A口进气可收集到的气体为 。
②用排水法收集某气体,可在该容器中充满水,气体应由 口进入。
(2)若用该装置除去H2中的水分,容器中可盛放的试剂为 。
(6分)(1) ① SO2 ② B (2)浓硫酸
试题分析:(1)①由A口进气,说明收集的气体密度大于空气的,因此是SO2。
②用排水法收集某气体,可在该容器中充满水,则气体应由B口进入,水从A排出。
(2)干燥氢气可以选择浓硫酸。
点评:常见气体的收集方法是:1.排水法,适用于不易溶于水的气体。例如氢气,氧气;2.向上排空气法,适用于比空气密度大,溶于水的气体,例如二氧化碳,氯气;3,向下排空气法,适用于比空气密度小,溶于水的气体,例如氨气。

练习册系列答案
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案
相关题目
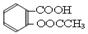 )是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下:
)是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如下: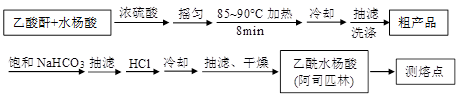
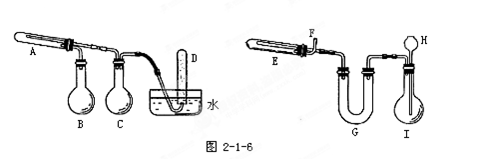
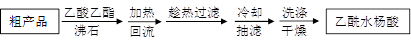 改进的提纯方法中加热回流的装置如图所示
改进的提纯方法中加热回流的装置如图所示
 [方案一]
[方案一]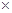 105Pa)的体积。
105Pa)的体积。