��Ŀ����
����Ŀ�����Ļ����Ϻ���Լ97%������ΪԼ3%���ں������ȣ��Ӹû������л������Ĺ���������ͼ��ʾ����֪���չ����У��������е������ڱ�������SeO2��TeO2���� 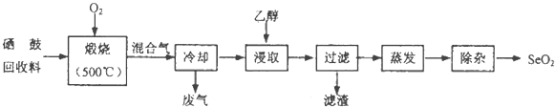
�������ʵ��������������
���� | �۵� | �е� | �ܽ�� |
SeO2 | 340�棨315�������� | 684�� | ������ˮ���Ҵ� |
TeO2 | 733�棨450�������� | 1260�� | ����ˮ���������Ҵ� |
�ش��������⣺
��1��Se��S��ͬ��Ԫ�أ���S��1�����Ӳ㣬Se��Ԫ�����ڱ���λ��Ϊ��H2Se�����ȶ��Ա�H2S�����ȶ������ǿ������������
��2���Ҵ���ȡ�����������������Ҫ�ɷ��� �� ������ȥ�ܼ������ù������Ժ�������TeO2���ʣ�����ʱ���˲��õķ����� ��
��3��SeO2������ˮ�õ�H2SeO3��Һ������Һ��ͨ��HI������ټ��������Һ����Һ����ɫ��ͬʱ����Se������д����Ӧ�Ļ�ѧ����ʽ ��
��4����֪H2SeO3�ĵ��볣��K1=3.5��10��3��K2=5.0��10��8 �� �ش��������⣺
��Na2SeO3��Һ���ԣ�ԭ���ǣ������ӷ���ʽ��ʾ����
����Na2SeO3��Һ�У����й�ϵʽ��ȷ������
A��c��Na+��+c��H+��=c��SeO32����+c��HSeO3����+c��OH����
B��2c��Na+��=c��SeO32����+c��HSeO3����+c��H2SeO3��
C��c��Na+��=2c��SeO32����+2c��HSeO3����+2c��H2SeO3��
D��c��OH����=c��H+��+c��HSeO3����+c��H2SeO3��
���𰸡�
��1�����ģ���4�����ڢ�A�壻��
��2��TeO2������
��3��H2SeO3+4HI=Se��+2I2+3H2O
��4���SeO32��+H2O?HSeO3��+OH����C
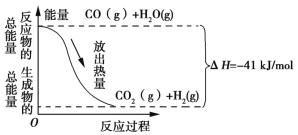
���������⣺��1.��Se��S��ͬ��Ԫ�أ���S��1�����Ӳ㣬��Se���⺬��4�����Ӳ㣬����㺬��6�����ӣ���Ԫ�����ڱ���λ�ڵ������ڡ���A�壻ͬһ�����зǽ�������������ǽ�����S��Se������H2Se�����ȶ��Ա�H2S�����ȶ����������Դ��ǣ����ģ���4�����ڢ�A�壻����
��2.�����պ�������Ҫ�ɷ�Ϊ����TeO2 �� ����TeO2����ˮ���������Ҵ��������Ҵ���ȡ�����������������Ҫ�ɷ���TeO2������SeO2�����������ȥSeO2������Te02���ʣ���ͨ�������ķ��������Դ��ǣ�TeO2��������
��3.��H2SeO3��Һ��HI�������ɵⵥ�ʺ�Se��������ѧ����ʽ��H2SeO3+4HI=Se��+2I2+3H2O�����Դ��ǣ�H2SeO3+4HI=Se��+2I2+3H2O��
��4.����H2SeO3�����ᣬˮ��ʼ��ԣ�SeO32��+H2OHSeO3��+OH�� �� ���Դ��ǣ��SeO32��+H2OHSeO3��+OH������A��c��SeO32������������ɣ�ӦΪc��Na+��+c��H+��=2c��SeO32����+c��HSeO3����+c��OH��������A���� BC����ԭ�Ӹ���ΪSe�����Ķ�����c��Na+��=2c��SeO32����+2c��HSeO3����+2c��H2SeO3������B����C��ȷ��D�����������غ�ɵã�c��OH����=c��HCO3����+2c��H2CO3��+c��H+������D�������Դ��ǣ�C��

 ������ĩ��ϰ��ѵ��ϵ�д�
������ĩ��ϰ��ѵ��ϵ�д� С��ʿ��ĩ����100��ϵ�д�
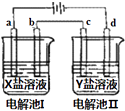
С��ʿ��ĩ����100��ϵ�д�����Ŀ����ͼ��ʾ�ĵ���I�͢��У�a��b��c��d��ΪPt�缫���������У��缫b��d��û�������ݳ���������������������b��d����������ʵ����������Һ�ǣ� ��
ѡ�� | X | Y |
A | AgNO3 | Cu��NO3��2 |
B | MgSO4 | CuSO4 |
C | FeSO4 | Al2��SO4��3 |
D | CuSO4 | AgNO3 |
A.A
B.B
C.C
D.D