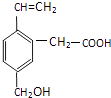
��Ŀ����
����Ŀ����һ��������þͭ�Ͻ���뵽100mLijŨ��HNO3��Һ�У�����ǡ�÷�Ӧ�����跴Ӧ�Ļ�ԭ����ֻ��NO���壬��������Һ�м������ʵ���Ũ��Ϊ3mol/L NaOH��Һ��������ȫ��������ɳ�����������ԭ�Ͻ����������5.1g���������й���������ȷ���ǣ� ��
A.����Ͻ������������Ϊ6.6g
B.�μӷ�Ӧ����������ʵ���Ũ��Ϊ1mol/L
C.���ɳ�����ȫʱ����NaOH��Һ�����Ϊ100 mL
D.����NO�������Ϊ2.24 L
���𰸡�C
���������⣺��һ������þ��ͭ�Ͻ���뵽ϡHNO3�У�����ǡ�÷�Ӧ�����������ᶼû��ʣ�࣬��Ӧ�л�ԭ����ֻ��NO��������Ӧ��3Mg+8HNO3��ϡ���T3Mg��NO3��2+2NO��+4H2O��3Cu+8HNO3��ϡ���T3Cu��NO3��2+2NO��+4H2O��
��Ӧ�����Һ�м���3mol/L NaOH��Һ��������ȫ��������Ӧ��Mg��NO3��2+2NaOH�TMg��OH��2��+2NaNO3��Cu��NO3��2+2NaOH�TCu��OH��2��+2NaNO3 �� ����Ϊ������þ��������ͭ�����ɳ�����������ԭ�Ͻ����������5.1g����������þ��������ͭ����������������Ϊ5.1g�������������ʵ���Ϊ ![]() =0.3mol�����ݵ���ת���غ㣬��þ��ͭ���ܵ����ʵ���Ϊ
=0.3mol�����ݵ���ת���غ㣬��þ��ͭ���ܵ����ʵ���Ϊ ![]() =0.15mol������NOΪ
=0.15mol������NOΪ ![]() =0.1mol��
=0.1mol��
A��������������֪��þ��ͭ���ܵ����ʵ���Ϊ0.15mol��������������3.6g��9.6����A����
B�����ݷ���ʽ��֪�μӷ�Ӧ��n��Ӧ��HNO3��=4n��NO��=0.4mol����ԭ�������ʵ���Ũ��Ϊ ![]() =4mol/L����B����
=4mol/L����B����
C���������������ǡ��������þ������ͭ��Ӧ��������������֪�������NaOHΪ0.3mol���ʼ���NaO��Һ�����Ϊ ![]() =0.1L=100mL����C��ȷ��
=0.1L=100mL����C��ȷ��
D�������NO�����Ϊ0.1mol��22.4L/mol=2.24L��״����֪����D����
��ѡC��

 ȫ�ܲ����ĩС״Ԫϵ�д�
ȫ�ܲ����ĩС״Ԫϵ�д�����Ŀ�����Ļ����Ϻ���Լ97%������ΪԼ3%���ں������ȣ��Ӹû������л������Ĺ���������ͼ��ʾ����֪���չ����У��������е������ڱ�������SeO2��TeO2���� 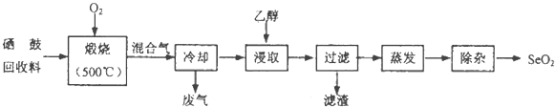
�������ʵ��������������
���� | �۵� | �е� | �ܽ�� |
SeO2 | 340�棨315�������� | 684�� | ������ˮ���Ҵ� |
TeO2 | 733�棨450�������� | 1260�� | ����ˮ���������Ҵ� |
�ش��������⣺
��1��Se��S��ͬ��Ԫ�أ���S��1�����Ӳ㣬Se��Ԫ�����ڱ���λ��Ϊ��H2Se�����ȶ��Ա�H2S�����ȶ������ǿ������������
��2���Ҵ���ȡ�����������������Ҫ�ɷ��� �� ������ȥ�ܼ������ù������Ժ�������TeO2���ʣ�����ʱ���˲��õķ����� ��
��3��SeO2������ˮ�õ�H2SeO3��Һ������Һ��ͨ��HI������ټ��������Һ����Һ����ɫ��ͬʱ����Se������д����Ӧ�Ļ�ѧ����ʽ ��
��4����֪H2SeO3�ĵ��볣��K1=3.5��10��3��K2=5.0��10��8 �� �ش��������⣺
��Na2SeO3��Һ���ԣ�ԭ���ǣ������ӷ���ʽ��ʾ����
����Na2SeO3��Һ�У����й�ϵʽ��ȷ������
A��c��Na+��+c��H+��=c��SeO32����+c��HSeO3����+c��OH����
B��2c��Na+��=c��SeO32����+c��HSeO3����+c��H2SeO3��
C��c��Na+��=2c��SeO32����+2c��HSeO3����+2c��H2SeO3��
D��c��OH����=c��H+��+c��HSeO3����+c��H2SeO3��