题目内容
设NA为阿伏加德罗常数,则下列说法正确的是
| A.电解精炼铜时,若阴极得到电子数为2 NA,阳极质量减少64g |
| B.200mL某硫酸盐溶液中含有1.5 NA个SO42-离子,同时含有NA个金属阳离子,该盐物质的量浓度是2.5 mol/L |
| C.常温常压下,78g Na2O2固体中所含阴、阳离子总数为4 NA |
| D.一定条件下,足量的Fe粉与浓硫酸反应,转移电子数一定为2 NA |
B
解析试题分析:A、由于粗铜中含有杂质,所以电解精炼铜时,若阴极得到电子数为2 NA,阳极质量不一定减少64g,A不正确;B、该硫酸盐溶液中SO42-离子与金属阳离子的个数之比=1.5:1.0=3:2,即化学式可表示为M2(SO4)3,因此根据SO42-离子的物质的量是1.5mol可知,该硫酸盐的物质的量是0.5mol,则其浓度=0.5mol÷0.2L=2.5mol/L,B正确;C、过氧化钠晶体中阴阳离子的个数之比是1:2,78g过氧化钠的物质的量是1mol,所以常温常压下,78g Na2O2固体中所含阴、阳离子总数为3NA,C不正确;D、参加反应的铁和浓硫酸的物质的量不能确定,因此不能确定反应中转移电子的物质的量,D不正确,答案选B。
考点:考查阿伏加德罗常数的计算

下列化学用语书写正确的是
| A.氢气分子的电子式:H∶H |
B.硫原子的结构示意图: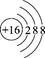 |
C.溴化钠的电子式: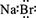 |
D.苯的分子式: |
300 mL Al2(SO4)3溶液中,含Al3+为1.62 g,在该溶液中加入0.1 mol·L-1Ba(OH)2溶液300 mL(忽略溶液体积变化),反应后溶液中SO42-的物质的量浓度为
| A.0.4 mol·L-1 | B.0.1 mol·L-1 | C.0.2 mol·L-1 | D.0.3 mol·L-1 |
Na2O2、HCl、Al2O3三种物质在水中完全反应后,溶液中只含有Na+、H+、Cl―、OH―;且溶液呈中性,则Na2O2、HCl、Al2O3的物质的量之比可能为
| A.2︰4︰1 | B.3︰2︰1 | C.2︰3︰1 | D.4︰2︰1 |
有9.7 g Cu和Zn的合金与足量的稀HNO3反应,还原产物只有NO气体,其体积在标准状况下为2. 24 L。将溶液稀释为IL,测得溶液的pH=l,此时溶液中NO—3的浓度为
| A.0.3 mol/L | B.0.4 mol/L | C.0.5 mol/L | D.0.6 mol/L |
下列数量的物质中含原子数最多的是
| A.4℃时5.4mL水 | B.标准状况下5.6L二氧化碳 |
| C.0.4mol氧气 | D.10g氖 |
设NA为阿伏加德罗常数的值,下列叙述不正确的是( )
| A.常温下,4 g CH4含有NA个C—H共价键 |
| B.常温常压下,7.0 g乙烯与丙烯的混合物中含有氢原子的数目为NA |
| C.含有6.02×1023个中子的D2O的质量为2.0 g |
| D.1 mol Al3+完全水解生成Al(OH)3胶体粒子的数目为NA |
2008年5月我国汶川发生地震灾害,假若你是卫生防疫人员,为配制0.01 mol/L的KMnO4消毒液,下列操作导致所配溶液浓度偏高的是
| A.取KMnO4样品时不慎在表面沾了点蒸馏水 |
| B.溶解搅拌时有液体飞溅 |
| C.定容时俯视容量瓶刻度线 |
| D.摇匀后见液面下降,再加水至刻度线 |