题目内容
有9.7 g Cu和Zn的合金与足量的稀HNO3反应,还原产物只有NO气体,其体积在标准状况下为2. 24 L。将溶液稀释为IL,测得溶液的pH=l,此时溶液中NO—3的浓度为
| A.0.3 mol/L | B.0.4 mol/L | C.0.5 mol/L | D.0.6 mol/L |
B
解析试题分析: 这是一道有关电子守恒的问题。NO气体是Cu和Zn的合金还原HNO3得到的,在这个过程中,金属失去的电子跟HNO3得到电子数相等,生成0.1 mol的NO气体得到0.3 mol的电子,在这个过程中金属失去0.3 mol的电子,又由于都是二价金属,所以跟铜离子和锌离子结合的硝酸根离子的物质的量也为0.3 mol。再加上溶液中的0.1 mol的硝酸,总共是0.4mol的硝酸根离子,又因为溶液的体积为IL,所以选B。
考点:氧化还原中得失电子相等,也就是电子守恒的相关知识。

 阅读快车系列答案
阅读快车系列答案设NA为阿伏加德罗常数的值。下列说法正确的是
| A.常温常压下,0.1molCl2溶于水,Cl2与水发生反应转移的电子数目为0.1NA |
| B.常温常压下,0.2molAl与足量NaOH溶液反应,转移电子数为0.6 NA |
| C.常温常压下,500 mL 0.1mol/L醋酸溶液中含有分子的总数目为0.05NA |
| D.常温常压下,16g CH4与18 g NH4+所含质子数相等 |
NA代表阿伏加德罗常数,下列说法不正确的是
| A.一定量的Fe与含1mol HNO3的稀硝酸恰好反应,则被还原的氮原子数小于NA |
| B.1 L0.5mol/LNa2CO3溶液中含有的CO32-数目为0.5NA |
| C.标准状况下,2.24L Cl2与足量的Mg充分反应,转移的电子数目为0.2NA |
| D.0.1mol CH4所含的电子数为NA |
过氧化钠与CO2作用,反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2↑。当0.2molNa2O2与足量CO2完全反应后,下表对生成物Na2CO3和O2的描述中正确的是
| | Na2CO3的质量 | 关于O2的描述 |
| A | 21.2g | O2的摩尔质量是36g·mol-1 |
| B | 21.6g | 生成标准状况下O2的体积为2.24L |
| C | 21.6g | O2的摩尔质量是34g·mol-1 |
| D | 22.4 g | 生成标准状况下O2的体积为2.24mL |
把500mLNH4HCO3和Na2CO3的混合溶液分成五等份,取一份加入含amol氢氧化钠的溶液恰好反应完全;另取一份加入含b mol HCl的盐酸恰好反应完全,则该混合溶液中c(Na+)为( )
A.(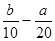 )mol/L )mol/L | B.(2b—a)mol/L | C.(l0b - 5a) mol/L | D.(5b一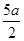 )mol/L )mol/L |
设NA为阿伏加德罗常数,则下列说法正确的是
| A.电解精炼铜时,若阴极得到电子数为2 NA,阳极质量减少64g |
| B.200mL某硫酸盐溶液中含有1.5 NA个SO42-离子,同时含有NA个金属阳离子,该盐物质的量浓度是2.5 mol/L |
| C.常温常压下,78g Na2O2固体中所含阴、阳离子总数为4 NA |
| D.一定条件下,足量的Fe粉与浓硫酸反应,转移电子数一定为2 NA |
1molSO2和1molSO3具有相同的:①分子数;②原子数;③S原子数;④O原子数
| A.①② | B.①③ | C.①④ | D.②④ |
amolFe与一定量的硝酸在一定条件下充分反应,将生成的气体与标准状况下b g O2混合,恰好能被水完全吸收,则a和b的关系可能是
| A.0.5a≤b≤0.75a | B.16a≤b≤24a | C.0.2a≤b≤0.3a | D.无法确定 |
有一稀硫酸和稀硝酸的混合酸,其中H2SO4和HNO3的物质的量浓度分别是4mol/L和2mol/L,取10mL此混合酸,向其中加入过量的铁粉,待反应结束后,可产生标准状况下气体的体积为(设反应中HNO3被还原成NO)( )
| A.0.448L | B.0.672L | C.0.896L | D.0.224L |