题目内容
【题目】以氮化镓(GaN)、砷化镓(GaAs)为代表的第三代半导体材料目前已成为全球半导体研究的前沿和热点,如砷化镓灯泡寿命是普通灯泡的100倍,而耗能仅为10%,推广砷化镓等发光二极管(LED)照明,是节能减排的有效举措。请回答下列问题:
(1)镓为元素周期表第31号元素,基态镓原子的电子排布式为___________,核外电子占据最高能层符号为________。
(2)氮化镓与金刚石具有相似的晶体结构,氮化镓中氮原子与镓原子之间以_______键相结合,氮化镓属于_______晶体。
(3)下列说法正确的是_______
A.第一电离能:As < Ga B.砷和镓都属于p区元素
C.电负性:As < Ga D.半导体GaP、SiC与砷化镓为等电子体
(4)①砷化镓是将(CH3)3Ga和AsH3用MOCVD(金属有机物化学气相淀积)方法制备得到的,该反应在700℃进行,反应的方程式为:____________________。
②反应物AsH3分子的几何构型为_______,(CH3)3Ga中镓原子杂化方式为___。
【答案】1s22s22p63s23p63d104s24p1或 [Ar]3d104s24p1 N 共价键 原子 BD (CH3)3Ga+AsH3![]() GaAs+3CH4 三角锥形 sp2杂化
GaAs+3CH4 三角锥形 sp2杂化
【解析】
(1)基态镓原子的电子排布式为1s22s22p63s23p63d104s24p1或[Ar]3d104s24p1,核外电子占据最高能层符号为:N,故答案为:1s22s22p63s23p63d104s24p1或[Ar]3d104s24p1;N;
(2)氮化镓与金刚石具有相似的晶体结构,则氮原子与镓原子之间以共价键结合,氮化镓属于原子晶体,故答案为:共价键;原子;
(3)A.As的核外电子排布式为[Ar]3d104s24p3,第一电离能从左到右呈现增大的趋势,由此可知,第一电离能:As>Ga,A错误;
B.砷位于第四周期第ⅤA族,镓位于第四周期第ⅢA族,第ⅢA族到第ⅦA族都属于p区元素,B正确;
C.元素非金属性越强,其电负性越大,同周期从左向右非金属性增强,故电负性:As>Ga,C错误;
D.GaP的价层电子为3+5=8,SiC的价层电子为4+4=8,GaAs的价层电子数为3+5=8,故半导体GaP、SiC与砷化镓为等电子体,D正确;
故答案为:BD;
(4)①结合原子守恒可得该化学反应方程式为(CH3)3Ga+AsH3![]() GaAs+3CH4,故答案为:(CH3)3Ga+AsH3
GaAs+3CH4,故答案为:(CH3)3Ga+AsH3![]() GaAs+3CH4;
GaAs+3CH4;
②对于AsH3,中心As原子的价电子对数=![]() =4,则VSEPR模型为四面体,但由于存在一对孤电子对,占据四面体的一个顶点,则其几何构型为三角锥形,对于(CH3)3Ga,Ga形成3个共价键,Ga为硼族元素,价电子排布式为4s24p1,根据杂化轨道理论,形成3个共价键时,无孤电子对,为sp2杂化,故答案为:三角锥形;sp2杂化。
=4,则VSEPR模型为四面体,但由于存在一对孤电子对,占据四面体的一个顶点,则其几何构型为三角锥形,对于(CH3)3Ga,Ga形成3个共价键,Ga为硼族元素,价电子排布式为4s24p1,根据杂化轨道理论,形成3个共价键时,无孤电子对,为sp2杂化,故答案为:三角锥形;sp2杂化。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案【题目】某实验室废液含![]() 、Na+、Fe3+、Cr3+、
、Na+、Fe3+、Cr3+、![]() 、
、![]() 等离子,现通过如下流程变废为宝制备K2Cr2O7。
等离子,现通过如下流程变废为宝制备K2Cr2O7。
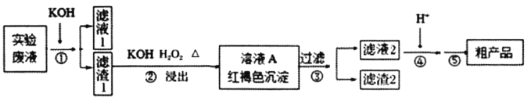
已知:
(a)![]() ;
;![]()
(b)金属离子形成氢氧化物沉淀的pH范围如表。
金属离子 | pH | |
开始沉淀 | 完全沉淀 | |
Fe3+ | 2.7 | 3.7 |
Cr3+ | 4.9 | 6.8 |
请回答:
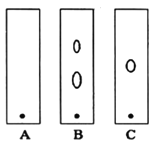
(1)某同学采用纸层析法判断步骤①加入KOH的量是否合适。在加入一定量KOH溶液后,用毛细管取样、点样、薄层色谱展开、氨熏后的斑点如图所示。加入KOH最适合的实验编号是(实验顺序已打乱)________,C的斑点颜色为________。
(2)步骤②含Cr物质发生的主要反应的离子方程式为________________________。
(3)在下列装置中,②应选用________。(填标号)
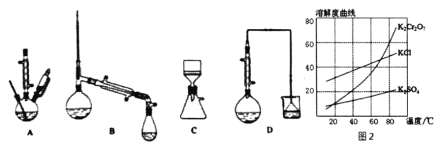
(4)部分物质的溶解度曲线如图2,步骤⑤可能用到下列部分操作:a.蒸发至出现大量晶体,停止加热;b.冷却至室温;c,蒸发至溶液出现晶膜,停止加热;d.洗涤;e.趁热过滤;f.抽滤。请选择合适操作的正确顺序________。
(5)步骤⑤中合适的洗涤剂是________(“无水乙醇”、“乙醇-水混合液”、“热水”、“冰水”)。
(6)取mg粗产品配成250mL溶液,取25.00mL于锥形瓶中,用cmol·L-1的(NH4)2Fe(SO4)2标准溶液滴定(杂质不反应),消耗标准(NH4)2Fe(SO4)2溶液VmL,则该粗产品中K2Cr2O7的纯度为________。