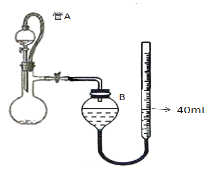
题目内容
【题目】下列关于物质性质递变规律的叙述不正确的是( )
A.单质的还原性:![]()
B.单质的氧化性:![]()
C.含氧酸的酸性:![]()
D.氢化物的稳定性:![]()
【答案】D
【解析】
A.同周期从左到右,金属原子的还原性逐渐减弱,因此还原性Na>Mg>Al,同主族自上而下,金属原子的还原性逐渐增强,因此还原性K>Na,故A正确;
B.同主族元素从上到下非金属依次减弱,所以非金属性Cl>Br>I,所以单质的氧化性Cl2>Br2>I2,故B正确;
C.非金属性越强,最高价氧化物对应水化物的酸性越强,因非金属性Cl>S>P>C,所以酸性:H2CO3<H3PO4<H2SO4<HClO4,故C正确;
D.同周期从左到右非金属性逐渐增强,非金属性Cl>S>P>Si,因此氢化物的稳定性:HCl>H2S>PH3>SiH4,故D错误;
故答案为D。

【题目】元素周期表是学习化学的重要工具,它隐含着许多信息和规律。下表所列是五种短周期元素的原子半径及主要化合价(已知铍的原子半径为0.089 nm)。
元素代号 | A | B | C | D | E |
原子半径/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
主要化合价 | +2 | +3 | +6、-2 | -1 | -2 |
(1)用元素代号标出它们在周期表中所对应的位置(以下为周期表的一部分)_________。
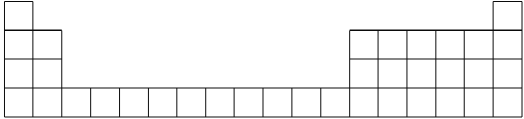
(2)画出A的原子结构示意图_________。
(3)B元素处于周期表中第________周期,________族。
(4)E元素处于周期表中第________周期,________族。
(5)C、D的简单离子的半径由大到小顺序为________(用离子符号表示)。
(6)上述五种元素的最高价氧化物对应的水化物中酸性最强的是__________(填化学式)。
(7)C、E形成的化合物为________(填化学式)。
(8)写出B单质和氢氧化钠溶液反应的方程式__________写出B的最高价氧化物对应水化物和氢氧化钠溶液反应的离子方程式:________
【题目】![]() 、
、![]() 、
、![]() 、
、![]() 是四种短周期元素,它们的核电荷数依次增大,四种元素的性质或原子结构的部分信息如表所示。
是四种短周期元素,它们的核电荷数依次增大,四种元素的性质或原子结构的部分信息如表所示。
元素 | 元素性质或原子结构的部分信息 |
| 元素的离子核外无电子 |
| 地壳中含量最多的元素 |
| 元素的离子半径在该周期中最小 |
|
|
下列叙述不正确的是( )
A.![]() 与
与![]() 形成的化合物在常温下为气体
形成的化合物在常温下为气体
B.![]() 的最高价氧化物对应的水化物不与
的最高价氧化物对应的水化物不与![]() 溶液反应
溶液反应
C.![]() 和
和![]() 形成的常见化合物能形成酸雨
形成的常见化合物能形成酸雨
D.简单氢化物的稳定性:![]()