题目内容
19.(1)按元素周期表结构规律,82号元素X应是第六周期ⅣA族元素,它的最高正价氧化物的化学式为PbO2. (用元素符号或代号R表示相应的氧化物)(2)以下反应:①木炭与水制备水煤气 ②高锰酸钾的分解 ③氢气与氯气混合见光爆炸 ④硫酸与烧碱反应 ⑤生石灰与水作用制熟石灰 ⑥Ba(OH)2•8H2O与NH4Cl⑦硫酸溶解于水⑧硝酸铵溶解于水.属于放热反应③④⑤(填序号),写出反应⑥的化学方程式Ba(OH)2•8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O.
(3)在下列化合物中:H2O2、Na2O、I2、NaCl、CO2、NH4Cl、Na2O2,用化学式回答下列问题:
①只由非金属组成的离子化合物是NH4Cl;
②只有极性共价键的共价化合物是CO2;
③只含有非极性共价键的是I2;
④既有离子键又有非极性键的化合物是Na2O2;
⑤其中所有原子并没有都满足8电子结构的是H2O2、NH4Cl;
⑥用电子式表示Na2O的形成过程
 .
.
分析 (1)稀有气体原子序数自上而下依次为2、10、18、36、54、86,82号元素与86号元素相差4,故二者同周期,82号元素处于第14列,即处于第六周期ⅣA族,为Pb元素,最高正化合价为+4,进而书写氧化物化学式;
(2)大多数的化合反应、所有燃烧反应、酸碱中和反应、金属与酸的反应等,属于放热反应,硫酸、氢氧化钠等溶解为放热过程;大多数的分解反应、以CO或碳或氢气为还原剂的反应、氢氧化钡与氯化铵的反应等,属于吸热反应,一些铵盐的溶解为吸热过程;
Ba(OH)2•8H2O与NH4Cl反应生成氯化钡、氨气与水;
(3)①铵盐是全部由非金属元素组成的离子化合物;
②只含共价键的化合物是共价化合物,不同非金属元素之间易形成极性共价键;
③同种非金属元素之间形成非极性共价键;
④活泼金属和活泼非金属元素之间易形成离子键,同种非金属元素之间易形成非极性共价键;
⑤含有H原子的化合物,分子中一定不满足所有原子均满足8电子结构;
⑥Na2O由钠离子与氧离子构成,用Na原子、氧原子电子式表示其形成.
解答 解:(1)稀有气体原子序数自上而下依次为2、10、18、36、54、86,82号元素与86号元素相差4,故二者同周期,82号元素处于第14列,即处于第六周期ⅣA族,为Pb元素,最高正化合价为+4,最高价氧化物的化学式为PbO2,
故答案为:硫、ⅣA;PbO2;
(2)①木炭与水制备水煤气,属于吸热反应,②高锰酸钾的分解,属于吸热反应,③氢气与氯气混合见光爆炸,属于放热反应,④硫酸与烧碱反应,属于放热反应,⑤生石灰与水作用制熟石灰,属于放热反应,⑥Ba(OH)2•8H2O与NH4Cl,属于吸热反应,⑦硫酸溶解于水,属于放热过程,⑧硝酸铵溶解于水吸热过程,属于放热反应有③④⑤,反应⑥的化学方程式:Ba(OH)2•8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O,
故答案为:③④⑤;Ba(OH)2•8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O;
(3)①铵盐是全部由非金属元素组成的离子化合物,符合条件的是氯化铵,故答案为:NH4Cl;
②只含共价键的化合物是共价化合物,不同非金属元素之间易形成极性共价键,只有极性键构成的共价化合物为CO2,故答案为:CO2;
③同种非金属元素之间形成非极性共价键,符合条件的是I2,故答案为:I2;
④活泼金属和活泼非金属元素之间易形成离子键,同种非金属元素之间易形成非极性共价键,则符合条件的是Na2O2,故答案为:Na2O2;
⑤上述化合物中H2O2、NH4Cl不满足所有原子均满足8电子结构,故答案为:H2O2、NH4Cl;
⑥Na2O由钠离子与氧离子构成,用Na原子、氧原子电子式表示其形成为 ,
,
故答案为: .
.
点评 本题考查位置结构性质关系、吸热反应与放热反应、化学键等,属于拼合型题目,需要学生熟练掌握基础知识,难度不大.

 备战中考寒假系列答案
备战中考寒假系列答案| A. | 电子有得失 | B. | 共用电子对有偏移 | ||
| C. | 电子既有得失又有偏移 | D. | 金属元素的存在 |
| A. | 酸性:H2CO3>H2SiO3>H3PO4 | B. | 碱性:CsOH>Ba(OH)2>Ca(OH)2 | ||
| C. | 热稳定性:H2O>HF>NH3>HCl | D. | 氧化性:Ag+<Cu2+<H+<Fe2+ |
| A. | NO 0.001 mol•L-1 | B. | H2O 0.002 mol•L-1 | ||
| C. | NH3 0.002 mol•L-1 | D. | O2 0.0025 mol•L-1 |
 非金属元素H、C、N、O、S、Cl能形成的化合物种类很多,单质及化合物的用途很广泛,完成下列各题.
非金属元素H、C、N、O、S、Cl能形成的化合物种类很多,单质及化合物的用途很广泛,完成下列各题.(1)①O2-的核外电子排布式为1s22s22p6,CS2的晶体类型为分子 晶体,其C的轨道杂化方式为sp
②CH3OH在常温下为液态,沸点高于乙烷的主要原因是甲醇分子间能形成氢键、乙烷分子间不能形成氢键;
(2)Cl2是一种大气污染物,液氯储存区贴有的说明卡如下(部分):
| 危险性 |  |
| 储运要求 | 远离金属粉末、氨、烃类、醇类物质;设置氯气检测仪 |
| 泄漏处理 | NaOH、NaHSO3溶液吸收 |
| 包装 | 钢瓶 |
②若液氯泄漏后遇到苯,在钢瓶表面氯与苯的反应明显加快,原因是铁与氯气反应生成的氯化铁,对氯与苯的反应有催化作用.
③将Cl2通入适量KOH溶液中,产物中可能有KCl、KClO、KClO3.当溶液中c(Cl-):c(ClO-)=11:1时,则c(ClO-):c(ClO3-)比值等于$\frac{1}{2}$
(3)室温时,向100mL 0.1mol•L-1 NH4HSO4溶液中滴加0.1mol•L-1 NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示.
试分析图中a、b、c、d四个点,水的电离程度最大的是a;在b点,溶液中各离子浓度由大到小的排列顺序是c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+).
| A. | CO2 | B. | COCl2 | C. | C2H2 | D. | H2O2 |
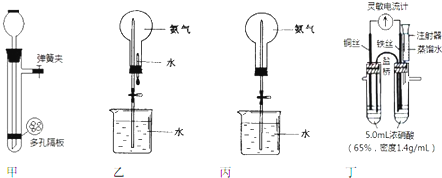

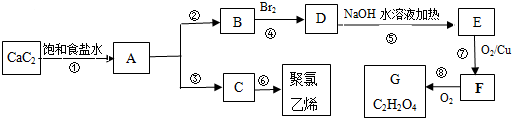
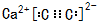 ,A的结构式H-C≡C-H,B分子中碳原子的杂化方式是sp2
,A的结构式H-C≡C-H,B分子中碳原子的杂化方式是sp2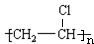 .
.