题目内容
9.试用杂化轨道理论说明下列分子的杂化类型和几何构型.(1)CO2:sp杂化;几何构型直线形;
(2)SiF4:sp3杂化;几何构型正四面体;
(3)BCl3:sp2杂化;几何构型平面三角形;
(4)NF3:sp3杂化;几何构型三角锥形;
(5)苯:sp2杂化;几何构型平面形.
分析 首先判断中心原子形成的δ键数目,然后判断孤对电子数目,以此判断杂化类型,结合价层电子对互斥模型可判断分子的空间构型.
解答 解:(1)CO2中C原子形成2个δ键,孤对电子数为$\frac{4-2×2}{2}$=0,则为sp杂化,为直线形,
故答案为:sp;直线形;
(2)SiF4中Si原子形成4个δ键,孤对电子数=$\frac{4-4×1}{2}$=0,则杂化sp3,为正四面体结构,
故答案为:sp3;正四面体;
(3)BCl3中B原子形成3个δ键,孤对电子数为$\frac{3-3×1}{2}$=0,则为sp2杂化,为平面三角形,
故答案为:sp2;平面三角形;
(4)NF3中N原子形成3个δ键,孤对电子数为$\frac{5-3×1}{2}$=1,则为sp3杂化,为三角锥形,
故答案为:sp3;三角锥形;
(5)苯中每个C原子形成3个δ键,不含孤电子对,为sp2杂化,为平面形,
故答案为:sp2;平面形.
点评 本题考查原子杂化方式判断及微粒空间构型判断,为高频考点,明确价层电子对互斥理论是解本题关键,易错点是孤电子对的计算方法,题目难度不大.

练习册系列答案
 期末集结号系列答案
期末集结号系列答案
相关题目
20.下列说法正确的是( )
| A. | 稀有气体元素最外层电子数均为8个 | |
| B. | 原子最外层少于4个电子的元素均是金属元素 | |
| C. | 相同条件下,H2O的沸点比H2S高是因为水分子间含有氢键 | |
| D. | 目前人们已发现了5000多种核素,说明发现了5000多种元素 |
17.已知五种短周期元素的原子半径及主要化合价如下表:
下列叙述正确的是( )
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.104 | 0.111 | 0.066 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
| A. | L与T形成的化合物属于共价化合物 | |
| B. | M的最高价氧化物的水化物具有两性 | |
| C. | T、Q的氢化物常温常压下均为无色气体 | |
| D. | L、M的单质与稀盐酸反应速率:M>L |
4.金属的下列性质中,与金属的晶体结构无关的是( )
| A. | 易导电 | B. | 易导热 | C. | 有延展性 | D. | 易锈蚀 |
14.下列说法正确的是( )??
| A. | 苯不能使酸性KMnO4溶液褪色,与甲烷性质相似,因此苯为饱和烃 | |
| B. | 苯的结构简式为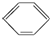 ,有三个双键,可与溴水发生加成反应 ,有三个双键,可与溴水发生加成反应 | |
| C. | 苯的6个碳原子和6个氢原子在同一平面内 | |
| D. | 将1mL苯和1mL水充分混合后静置,二者互溶 |
1.既可以用来鉴别乙烯和甲烷,又可以用来除去甲烷中混有的乙烯,得到纯净的甲烷的方法是( )
| A. | 通入酸性KMnO4溶液 | B. | 通入澄清石灰水 | ||
| C. | 通入足量的溴水 | D. | 通入浓硫酸 |
18.碱性电池具有容量大、放电电流大的特点,因而得到广泛使用,锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应为Zn+2MnO2+H2O═Zn(OH)2+Mn2O3,下列说法错误的是( )
| A. | 电池工作时,锌失去电子 | |
| B. | 电池正极反应式为:2MnO2+H2O+2e-═Mn2O3+2OH- | |
| C. | 电池工作时,电子由正极通过外电路流向负极 | |
| D. | 电池工作时,电解质溶液中OH?的物质的量近似不变 |
13.据国外资料报道,在一种共生矿--独居石中,查明有尚未命名的116号元素,判断116号元素应位于周期表中的( )
| A. | 第6周期ⅣA族 | B. | 第7周期Ⅶ族 | C. | 第7周期ⅥA族 | D. | 第8周期ⅥA族 |
 .
.