题目内容
20.某小组同学为比较酸性条件下NO3-、SO42-、Fe3+的氧化性强弱,设计如图实验(夹持仪器已略去,装置的气密性已检验).
实验记录如下:
| 实验操作 | 实验现象 | |
| Ⅰ | 打开活塞c,将过量稀HNO3加入装置B中,关闭活塞c | B中浅绿色溶液最终变为黄色. |
| Ⅱ | 用注射器取出少量B装置中的溶液,加入KSCN溶液 | 溶液变为红色. |
| Ⅲ | 打开活塞b,向A装置中加入足量硫酸,关闭活塞b | A中产生气体;B中有气泡,液面上有少量红棕色气体生成. |
| Ⅳ | 一段时间后,用注射器取出少量B装置中的溶液,… | … |
| Ⅴ | 打开活塞a,通入一段时间空气 | ---- |
(1)实验Ⅰ中,发生反应的离子方程式是3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O.
(2)实验Ⅳ的后续操作是加入K3[Fe(CN)6]溶液,观察到的现象是生成蓝色沉淀.
(3)由实验得出的结论:酸性条件下氧化性由大到小的顺序是氧化性:NO3->Fe3+>SO42-.
(4)实验操作Ⅴ的目的是将装置中的SO2、NO、NO2等气体排进NaOH溶液中吸收,防止污染大气.
(5)实验操作Ⅲ,开始时B中溶液的颜色并无明显变化,此时溶液中发生反应的离子方程式是3SO2+2NO3-+2H2O═3SO42-+2NO↑+4H+.
分析 (1)打开活塞c,将过量稀HNO3加入装置B中,关闭活塞c,B中浅绿色溶液立即变为深棕色;一段时间后,溶液最终变为黄色,亚铁离子被氧化为铁离子;
(2)打开活塞b,向A装置中加入足量硫酸,关闭活塞b,A中产生气体;B中有气泡,液面上有少量红棕色气体生成,一段时间后,用注射器取出少量B装置中的溶液为亚铁离子的溶液,加入K3[Fe(CN)6]溶液生成蓝色沉淀,
(3)氧化还原反应中的氧化剂的氧化性大于氧化产物分析;
(4)打开活塞a,通入一段时间空气是将装置中的SO2、NO、NO2等气体排进NaOH溶液中吸收;
(5)实验操作Ⅲ,打开活塞b,向A装置中加入足量硫酸,关闭活塞b,开始时B中溶液的颜色并无明显变化是稀硝酸氧化二氧化硫的反应生成硫酸和一氧化氮气体.
解答 解:(1)打开活塞c,将过量稀HNO3加入装置B中,关闭活塞c,B中浅绿色溶液立即变为深棕色;一段时间后,溶液最终变为黄色,亚铁离子被氧化为铁离子,反应的离子方程式为:3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O,
故答案为:3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O;
(2)打开活塞b,向A装置中加入足量硫酸,关闭活塞b,A中产生气体;B中有气泡,液面上有少量红棕色气体生成,一段时间后,用注射器取出少量B装置中的溶液为亚铁离子的溶液,加入K3[Fe(CN)6]溶液生成蓝色沉淀,
故答案为:加入K3[Fe(CN)6]溶液;生成蓝色沉淀;
(3)实验Ⅰ是硝酸氧化亚铁离子,说明硝酸的影响大于氧化产物铁离子,实验操作Ⅲ,打开活塞b,向A装置中加入足量硫酸,关闭活塞b,开始时B中溶液的颜色并无明显变化是稀硝酸氧化二氧化硫的反应生成硫酸和一氧化氮气体,说明硝酸氧化性大于氧化物硫酸,实验Ⅳ是二氧化硫通入铁盐溶液发生氧化还原反应,铁离子的影响大于氧化产物硫酸,氧化性大小为:NO3->Fe3+>SO42-,
故答案为:氧化性:NO3->Fe3+>SO42-;
(4)打开活塞a,通入一段时间空气,将装置中的SO2、NO、NO2等气体排进NaOH溶液中吸收,防止污染大气,
故答案为:将装置中的SO2、NO、NO2等气体排进NaOH溶液中吸收,防止污染大气;
(5)实验Ⅲ是生成的二氧化硫通入装置B溶液中硝酸根离子氧化二氧化硫生成硫酸,反应生成无色气体一氧化氮,反应的离子方程式为:3SO2+2NO3-+2H2O═3SO42-+2NO↑+4H+,
故答案为:3SO2+2NO3-+2H2O═3SO42-+2NO↑+4H+.
点评 本题考查了物质性质的实验分析判断,物质性质和离子检验,化学平衡和氧化还原反应的分析应用,掌握基础是解题关键,题目难度中等.

| A. | 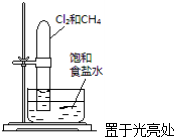 验证甲烷与氯气发生化学反应 | B. | 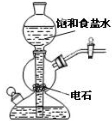 实验室制乙炔 | ||
| C. |  从碘与氯化钠的混合溶液中分离碘 | D. |  粗苯甲酸的提纯 |
| A. | Cl2+FeI2═FeCl2+I2 | |
| B. | 2Fe3++2I-═2Fe2++I2 | |
| C. | 2KMnO4+16HCl═2MnCl2+5Cl2↑+2KCl+8H2O | |
| D. | 2FeCl3+4FeI3═3Cl2+6FeI2 |
| A. | 标准状况下,22.4LNO与0.5molO2充分反应,最后得到NA个NO2分子 | |
| B. | 1.0L 0.5mol/L的NaAlO2水溶液中含有氧原子数为NA | |
| C. | 常温常压下,14g的C2H4和C4H8混合气体中含有的原子数为3NA | |
| D. | 某密闭容器盛有0.2molSO2和0.1molO2,在一定条件下充分反应,转移电子的数目为0.4NA |
| A. | 胶体和溶液一样都不带电,但是胶体中的胶体粒子可能带电 | |
| B. | 胶体、溶液和浊液这三种分散系的根本区别是分散质粒子直径的大小不同 | |
| C. | 胶体中的微粒不能透过滤纸 | |
| D. | 用激光笔的光束照射Fe(OH)3胶体会产生丁达尔效应 |
| A. | pH在5.6~7.0之间的降水通常称作酸雨 | |
| B. | 臭氧的体积分数超过10-4%的空气有利于人体健康 | |
| C. | 燃烧煤时加入适量石灰石,可减少废气中二氧化硫含量 | |
| D. | 含磷的合成洗涤剂易于被细菌分解,故不会导致水体污染 |