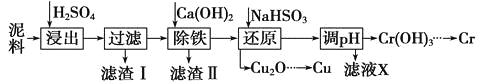
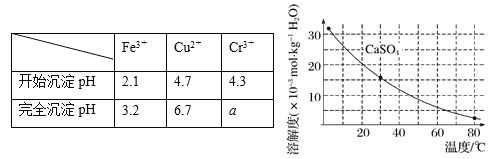
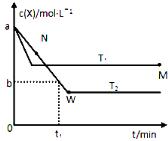
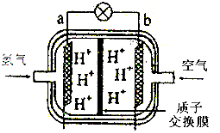
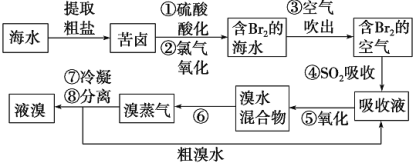
题目内容
【题目】一定量的乙醇在氧气不足的情况下燃烧,得CO、CO2和水的总质量为27.6g,若其中水的质量为10.8g,则CO的质量为
A.4.4g B.2.2g C.1.4g D.在2.2g与4. 4g之间
【答案】C
【解析】
试题分析:n(H2O)=10.8g÷18g/mol=0.6mol,根据H原子守恒,可知乙醇的物质的量=![]() =0.2mol,根据C原子守恒,可知CO和CO2的总的物质的量=0.2mol×2=0.4mol,由于水的质量为10.8g,所以一氧化碳和二氧化碳的质量为:27.6g-10.8g=16.8g;令CO、CO2的物质的量分别为xmol、ymol,则:x+y=0.4,28x+44y=16.8,解得x=0.05,y=0.35,所以原混合气中CO的质量为0.05mol×28g/mol=1.4g,故选C。
=0.2mol,根据C原子守恒,可知CO和CO2的总的物质的量=0.2mol×2=0.4mol,由于水的质量为10.8g,所以一氧化碳和二氧化碳的质量为:27.6g-10.8g=16.8g;令CO、CO2的物质的量分别为xmol、ymol,则:x+y=0.4,28x+44y=16.8,解得x=0.05,y=0.35,所以原混合气中CO的质量为0.05mol×28g/mol=1.4g,故选C。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目