题目内容
【题目】物质的化学变化乍看起来,好像十分复杂,难以把握,而实际上是有规律可循的。认识化学原理并将化学原理应用于实际正是化学的魅力所在。
I.在恒容密闭容器中通入X并发生反应:2X(g)![]() Y(g),温度T1、T2下X的物质的量浓度c(x)随时间t变化的曲线如图所示
Y(g),温度T1、T2下X的物质的量浓度c(x)随时间t变化的曲线如图所示
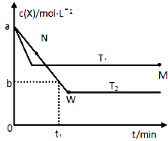
①该反应的化学平衡常数表达式为:_____________
②M点的正反应速率v正_________(填“>”、“=”或“<”)N点的逆反应速率v逆;T2下,在0~t1时间内,v(Y)=_______________;该反应进行到M点放出的热量_________(填“>”、“=”或“<”)进行到W点放出的热量。
③M点时再加入一定量的X,平衡后X的转化率___________(填“增大”、“减小”或“不变”)
II.0.1mol/LNaHCO3溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中离子浓度由大到小的顺序为_________________
III.下图是某种燃料电池原理示意图:
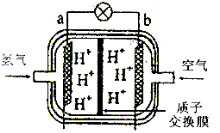
(1)该燃料电池工作过程中,其正极反应式为:________________________。
(2)若用此燃料电池作为电源向铁制品上镀上一层铜,则铁制品要连接在燃料电池的__________极(填“a”或“b”)上.若用此燃料电池电解精炼银,应使粗银作电解池的____________极,使用AgNO3和HNO3的混合溶液作电解液,若阴极有少量红棕色气体生成,则生成该气体的电极反应式为:__________________。
【答案】I.①K=c(Y)/c2(X);②>,(a-b)/2t1mol·L—1·min—1,<;③增大。
II.c(Na+)>c(CO32—)>c(OH-)>c(HCO3—)>c(H+)。
III.(1)O2+4H++4e-![]() 2H2O。
2H2O。
(2)a,阳极,NO3—+e-+2H+![]() NO2↑+2H2O。
NO2↑+2H2O。
【解析】
试题分析:I.①该反应的化学平衡常数表达式为K=c(Y)/c2(X)。
②根据图像可知,温度为T1时反应首先达到平衡状态。温度高反应速率快,到达平衡的时间少,则温度是T1>T2。M点温度高于N点温度,且N点反应没有达到平衡状态,此时反应向正反应方向进行,即N点的逆反应速率小于N点的正反应速率,因此M点的正反应速率大于N点的逆反应速率; T2下,在0~t1时间内,v(Y)=1/2v(X)=(a-b)/2t1mol·L—1·min—1;根据图像可知W点消耗的X的物质的量大于M点消耗X的物质的量,因此根据热化学方程式可知W点放出的热量多,该反应进行到M点放出的热量<进行到W点放出的热量。
③M点时再加入一定量的X,相当于增大压强,平衡正向移动,平衡后X的转化率增大。
II.0.1mol/LNaHCO3溶液与0.1mol/L NaOH溶液等体积混合,二者恰好完全反应生成碳酸钠,所得溶液中离子浓度由大到小的顺序为c(Na+)>c(CO32—)>c(OH-)>c(HCO3—)>c(H+)。
III.(1)该燃料电池为酸性氢氧燃料电池,氢气在负极发生氧化反应,氧气在正极发生还原反应,正极反应式为:O2+4H++4e-![]() 2H2O。
2H2O。
(2)该电池a为电池的负极,b为电池的正极,若用此燃料电池作为电源向铁制品上镀上一层铜,则铁制品要连接在燃料电池的负极,即a极;若用此燃料电池电解精炼银,应使粗银作电解池的阳极,使用AgNO3和HNO3的混合溶液作电解液,若阴极有少量红棕色气体生成,则生成该气体的电极反应式为:NO3—+e-+2H+![]() NO2↑+2H2O。
NO2↑+2H2O。

