题目内容
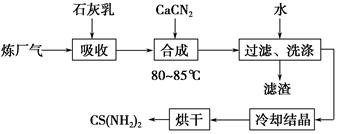
易溶于水的三草酸合铁(Ⅲ)酸钾晶体K3[Fe(C2O4)3]·3H2O可用于摄影和蓝色印刷。以铁屑为原料的制备流程如下:
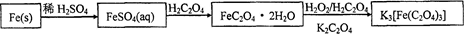
请回答下列问题:
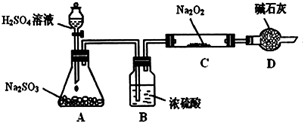
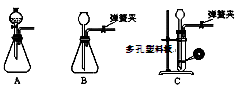
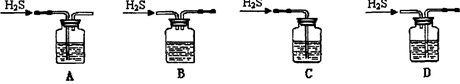
(1)铁屑中常含硫元素,加稀硫酸时会产生有毒的H2S气体,可用氢氧化钠溶液吸收,下列吸收装置正确的是 。
(2)制得的FeSO4溶液中需加入少量的H2SO4酸化,目的是 。若要从溶液中得到绿矾FeSO4·7H2O,必须进行的实验操作是 (按顺序填写)。
a.过滤洗涤 b.蒸发浓缩 c.冷却结晶 d.灼烧 e.干燥
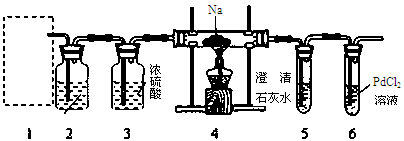
(3)该晶体盐在110℃可完全失去结晶水,继续升高温度可发生分解反应。
①分解得到的气体产物用如下装置进行实验
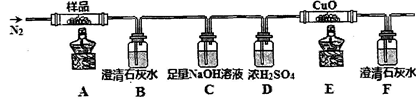
装置检查气密性后,先通一段时间N2,其目的为 。结束实验时先熄灭酒精灯再通入N2至常温,其目的为 。实验过程中观察到B、F中澄清石灰水都变浑浊,E中有红色固体生成,则气体产物是 。
②分解得到的固体产物含有K2CO3、FeO、Fe,加水溶解、过滤、洗涤、干燥,得到含铁样品。现设计下列三种实验方案对该样品进行物质含量测定。
【甲】a g样品 溶液
溶液
 得固体b g
得固体b g
【乙】a g样品
 量气测得气体体积Va mL
量气测得气体体积Va mL
【丙】a g样品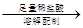 250 mL溶液
250 mL溶液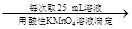 三次平均消耗0.1 mol·L-1酸性KMnO4溶液Vb mL你认为以上方案中 无法确定样品的组成,理由是 。
三次平均消耗0.1 mol·L-1酸性KMnO4溶液Vb mL你认为以上方案中 无法确定样品的组成,理由是 。
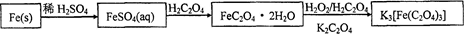
请回答下列问题:
(1)铁屑中常含硫元素,加稀硫酸时会产生有毒的H2S气体,可用氢氧化钠溶液吸收,下列吸收装置正确的是 。

(2)制得的FeSO4溶液中需加入少量的H2SO4酸化,目的是 。若要从溶液中得到绿矾FeSO4·7H2O,必须进行的实验操作是 (按顺序填写)。
a.过滤洗涤 b.蒸发浓缩 c.冷却结晶 d.灼烧 e.干燥
(3)该晶体盐在110℃可完全失去结晶水,继续升高温度可发生分解反应。
①分解得到的气体产物用如下装置进行实验

装置检查气密性后,先通一段时间N2,其目的为 。结束实验时先熄灭酒精灯再通入N2至常温,其目的为 。实验过程中观察到B、F中澄清石灰水都变浑浊,E中有红色固体生成,则气体产物是 。
②分解得到的固体产物含有K2CO3、FeO、Fe,加水溶解、过滤、洗涤、干燥,得到含铁样品。现设计下列三种实验方案对该样品进行物质含量测定。
【甲】a g样品
 溶液
溶液
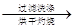 得固体b g
得固体b g【乙】a g样品
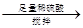
 量气测得气体体积Va mL
量气测得气体体积Va mL【丙】a g样品
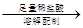 250 mL溶液
250 mL溶液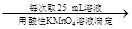 三次平均消耗0.1 mol·L-1酸性KMnO4溶液Vb mL你认为以上方案中 无法确定样品的组成,理由是 。
三次平均消耗0.1 mol·L-1酸性KMnO4溶液Vb mL你认为以上方案中 无法确定样品的组成,理由是 。(1)A (2)防止Fe2+的水解 b c a e
(3)①排出装置中的空气, 防止干扰实验结果 防止液体回流(或倒吸) CO2、CO
②丙方案 使用盐酸溶解样品,氯离子也可被酸性MnO4-氧化
(3)①排出装置中的空气, 防止干扰实验结果 防止液体回流(或倒吸) CO2、CO
②丙方案 使用盐酸溶解样品,氯离子也可被酸性MnO4-氧化
试题分析:(1)吸收杂质气体时导气管的连接方式是长进短出,而且长的导气管要浸没在液面下,短的导气管稍微露出橡胶塞即可。故选项为A。(2)制得的FeSO4溶液中需加入少量的H2SO4酸化,目的是防止Fe2+的水解而使溶液变浑浊。若要从溶液中得到绿矾FeSO4·7H2O,必须进行的实验操作是蒸发浓缩、冷却结晶、过滤洗涤、干燥。故选项为 b c a e。(3)①装置检查气密性后,要先通一段时间N2,其目的为了排出装置中的空气, 防止干扰实验结果。实验过程中观察到B中澄清石灰水变浑浊说明含有CO2,E中有红色固体生成,F中的澄清石灰水变浑浊则说明气体产物含有CO。所以气体产物是CO2、CO。②分解得到的固体产物含有K2CO3、FeO、Fe,加水溶解、过滤、洗涤、干燥,得到含铁样品。甲:样品ag,加入足量的硝酸溶解得到Fe(NO3)3,向溶液中加入足量的NaOH溶液得到Fe(OH)3沉淀,将其过滤出来洗涤干净,然后灼烧,发生反应:2Fe(OH)3
 Fe2O3+3H2O.烘干得到的固体质量就是Fe2O3的质量。进而计算出Fe元素的质量。因此再根据含铁样品的质量及Fe的质量就是出固体产物个组分的含量。正确。乙:向含铁样品中加入足量的稀硫酸发生反应:Fe+H2SO4=FeSO4+H2↑。根据放出的氢气的体积可计算出Fe的质量,继而求出FeO的质量,固体样品中个组分的含量得到求解。正确。丙:样品用足量的盐酸溶解时发生反应:Fe+2HCl=FeCl2+H2↑;FeO+2HCl=FeCl2+H2O.取25ml的溶液用酸性KMnO4溶液滴定时Fe2+、Cl-都被酸性高锰酸钾氧化,因此不能根据消耗的高锰酸钾溶液的物质的量的多少来确定溶液中Fe2+的多少。故不能确定样品中个组分含量的多少。错误。因此在这三种方案中丙无法确定物质的组成。
Fe2O3+3H2O.烘干得到的固体质量就是Fe2O3的质量。进而计算出Fe元素的质量。因此再根据含铁样品的质量及Fe的质量就是出固体产物个组分的含量。正确。乙:向含铁样品中加入足量的稀硫酸发生反应:Fe+H2SO4=FeSO4+H2↑。根据放出的氢气的体积可计算出Fe的质量,继而求出FeO的质量,固体样品中个组分的含量得到求解。正确。丙:样品用足量的盐酸溶解时发生反应:Fe+2HCl=FeCl2+H2↑;FeO+2HCl=FeCl2+H2O.取25ml的溶液用酸性KMnO4溶液滴定时Fe2+、Cl-都被酸性高锰酸钾氧化,因此不能根据消耗的高锰酸钾溶液的物质的量的多少来确定溶液中Fe2+的多少。故不能确定样品中个组分含量的多少。错误。因此在这三种方案中丙无法确定物质的组成。
练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目