题目内容
【题目】Ⅰ.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钠的主要反应为:2FeSO4 + 6 Na2O2 = 2Na2FeO4 + 2Na2O + 2Na2SO4 + O2↑,该反应中还原剂是___________________(填化学式),被2 mol FeSO4还原的过氧化钠为_________mol
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。写出碱性条件下制高铁酸钾的离子反应方程式:__________________________
Ⅱ.已知:2Fe3++2I-=2Fe2++I2,2Fe2++Br2=2Fe3++2Br-。
(1)含有1 mol FeI2和2 mol FeBr2的溶液中通入2 mol Cl2,此时被氧化的离子是____________,被氧化的离子的物质的量分别是_____________________________________________
(2)若向含a mol FeI2和b mol FeBr2的溶液中通入c mol Cl2,当I-、Fe2+被氧化时,c为_____________(用含a、b的代数式表示)。
【答案】FeSO4 Na2O2 4 2Fe(OH)3 + 3ClO- + 4OH- = 2FeO42- + 3Cl- + 5H2O I-、Fe2+ n(I-)=2mol n(Fe2+)=2mol c=(3a+b)/2
【解析】
Ⅰ(1)该反应中得电子的物质是过氧化钠,失电子的物质是过氧化钠和硫酸亚铁,所以氧化剂是过氧化钠,还原剂是过氧化钠和硫酸亚铁;2 mol FeSO4失去电子8mol,1mol Na2O2被还原得到电子为2mol,故被2 mol FeSO4还原的过氧化钠为![]() ;
;
(2)高铁酸钾是生成物,氢氧化铁是反应物,根据高铁酸钾和氢氧化铁中铁元素化合价的变化知氢氧化铁是还原剂,而氧化剂得电子反应后元素的化合价降低,根据所给离子中化合价变化的另一种元素是氯,且次氯酸根离子作反应物,氯离子作生成物,所以离子方程式为2Fe(OH)3+3ClO-+4OH-= 2FeO42—+3Cl-+5H2O;
Ⅱ(1)在氧化还原反应中还原剂的还原性强于还原产物,所以还原性强弱顺序是I-、Fe2+、Br-,所以氯气首先氧化的的是I-,然后是Fe2+,最后是Br-。根据电子的得失守恒可知,2molCl2能氧化2molI-和2molFe2+;
(2)根据电子的得失守恒可知,2c=2a+(a+b)+2b,即c=![]() 。
。

【题目】硫酸铝在造纸、水净化、土壤改良中有着广泛的应用,同时还是泡沫灭火器中的试剂。某化工厂利用含铝废料(成分为A12O3,SiO2及少量FeO·xFe2O3)制备硫酸铝晶体的工艺流程如下图所示,回答相关问题。
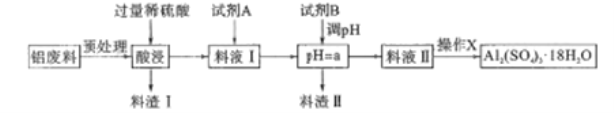
又知生成氢氧化物沉淀的pH如下表:
Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
开始沉淀时 | 3.6 | 6.3 | 2.3 |
完全沉淀时 | 4.9 | 8.3 | 3.2 |
(1)料渣I的成分是__,操作X的内容是__、洗涤、干燥等。
(2)试剂B最好是__,a的范围是__,由表中数据求出Ksp[Fe(OH)3]<_____(设沉淀完全时金属离子浓度小于1×10-5mol/L)。
(3)试剂A是一种液态绿色氧化剂,料液Ⅰ中反应的离子方程式_______
(4)泡沫灭火器容器构造分为内外两层,内层是玻璃容器、外层是钢筒。则硫酸铝溶液应盛放在______容器中,泡沫灭火器中另一种试剂是小苏打溶液而不是苏打溶液的原因是____.
(5)请设计一种简单的方案,用于确定所制得的晶体组成是否与理论上的组成[Al2(SO4)3·18H2O]相同(写出主要操作过程即可):_________________