题目内容
【题目】现有下列十种物质:①H2 ②铝 ③CaO固体 ④CO2 ⑤H2SO4 ⑥Ba(OH)2 ⑦熔融的KNO3 ⑧氨水 ⑨稀硝酸 ⑩Al2(SO4)3
(1)上述十种物质中有两种物质之间可发生离子反应:H++OH﹣=H2O,该离子反应对应的化学方程式为____________________________________。
(2)⑩在水中的电离方程式为___________________________。
(3)以上属于电解质的共有____________种。
(4)将少量的④通入⑥的溶液中反应的离子方程式为___________________________。
(5)配平② 与 ⑨发生反应的化学方程式,并用双线桥法标明该反应中电子转移的方向和数目____Al + ___HNO3 = ___Al(NO3)3 + ___NO↑ +__ ______ ;当有8.1g Al发生反应时,转移电子的物质的量为__________mol,HNO3的作用是酸和氧化剂其物质的量之比为_________。
【答案】Ba(OH)2 +2HNO3=Ba(NO3)2+2H2O Al2(SO4)3 =2Al3++3SO42- 5 Ba2++2OH-+CO2=BaCO3↓+2H2O 1 4 1 1 2 H2O 0.9 3:1
【解析】
(1)H++OH-═H2O表示强酸和强碱的酸碱中和反应,且酸碱反应中只有水生成,强酸是硝酸,强碱是氢氧化钡,反应方程式为Ba(OH)2+2HNO3=Ba(NO3)2+2H2O;
(2)Al2(SO4)3属于强电解质,故电离方程式为:Al2(SO4)3===2Al3++3SO42-;
(3)在水溶液里或熔融状态下能导电的化合物是电解质,③CaO、⑤H2SO4、⑥Ba(OH)2、⑦熔融的KNO3、⑩Al2(SO4)3是电解质;⑧氨水、⑨稀硝酸是混合物,不是电解质也不是非电解质;④CO2是非电解质,因此属于电解质的共有5种。
(4)少量二氧化碳和氢氧化钡反应生成碳酸钡和水,离子方程式为Ba2++2OH-+CO2=BaCO3↓+H2O
(5)其反应方程式及双线桥表示电子转移的方向和数目为: ;8.1gAl的物质的量为
;8.1gAl的物质的量为![]() ,故转移点电子的物质的量为0.9mol;有4mol硝酸参加反应时,有1mol硝酸作氧化剂被还原,3mol作酸与金属成盐。
,故转移点电子的物质的量为0.9mol;有4mol硝酸参加反应时,有1mol硝酸作氧化剂被还原,3mol作酸与金属成盐。

 阅读快车系列答案
阅读快车系列答案【题目】因瓦合金是铁和镍的合金,由于其膨胀系数极小,又称不变合金,适合做测量元件。回答下列问题:
(1)基态镍原子的价电子轨道表达式为_______;铁的基态原子核外未成对电子数为_______个。
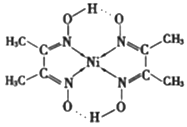
(2)在稀氨水介质中,Ni2+与丁二酮肟(分子式为C4H8N2O2)反应可生成鲜红色沉淀,其分子结构如下图所示,该结构中碳原子的杂化方式为_______;已知丁二酮肟分子结构中C-C键与N-O键的键长和键能数据如下表所示,请从原子结构角度解释N-O键的键能小于C-C键:_______。
化学键 | 键长 (10-12m) | 键能 (kJ/mol) |
C-C | 154 | 332 |
N-O | 146 | 230 |
(3)铁、镍易与CO作用形成羰基配合物Fe(CO)5、N(CO)4。1个Fe(CO)5分子中含有σ键数目为_______;已知Ni(CO)4分子为正四面体构型,下列溶剂能够溶解Ni(CO)4的是_______(填写字母)。
A.四氯化碳 B.苯 C.水 D.液氨
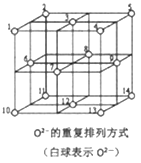
(4)镍晶胞为面心立方,其中镍原子的配位数为_______。氯化亚铁的熔点为674℃,而氯化铁的熔点仅为282℃,二者熔点存在差异的原因是_______。
(5)Fe3O4晶体中,O2-的重复排列方式如右图所示,该排列方式中存在着由如1、3、6、7的O2-围成的正四面体空隙和3、6、7、8、9、12的O2-围成的正八面体空隙。Fe3O4中有一半的Fe3+填充在正四面体空隙中,另一半Fe3+和Fe2+填充在正八面体空隙中,则Fe3O4晶体中,正四面体空隙数与O2-数之比为_______。Fe3O4晶胞中有8个图示结构单元,晶体密度为5.18g/cm3,则该晶胞参数a=_______cm(写出计算表达式即可)。