题目内容
7.某小组为研究电化学原理,设计如图装置.下列叙述不正确的是( )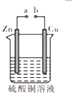
| A. | a和b不连接时,锌片上会有紫红色固体析出 | |
| B. | a和b用导线连接时,铜片上的电极反应是Cu2++2e-→Cu | |
| C. | a和b用导线连接时,溶液的颜色加深 | |
| D. | 无论a和b是否连接,锌片均会溶解 |
分析 A、a和b不连接时,Zn与硫酸铜溶液发生置换反应;
B、a和b用导线连接时,形成原电池,Zn作负极,Cu作正极;
C、a和b用导线连接时,电解质溶液为硫酸铜,形成原电池,总反应为Zn+Cu2+=Zn2++Cu,铜离子浓度减小;
D、无论a和b是否连接,都发生Zn+Cu2+=Zn2++Cu.
解答 解:A、a和b不连接时,Zn与硫酸铜溶液发生置换反应,则在Zn片上有金属铜析出,故A正确;
B、a和b用导线连接时,电解质溶液为硫酸铜,形成原电池,Cu作正极,发生还原反应,电极反应为Cu2++2e-=Cu,故B正确;
C、a和b用导线连接时,电解质溶液为硫酸铜,形成原电池,总反应为Zn+Cu2+=Zn2++Cu,铜离子浓度减小,所以溶液的颜色变浅,故C错误;
D、无论a和b是否连接,都发生Zn+Cu2+=Zn2++Cu,则锌片均会溶解,故D正确;
故选C.
点评 本题考查化学反应与原电池反应,明确原电池的工作原理及所发生的氧化还原反应是解答本题的关键,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
18.设NA为阿伏伽德罗常数,下列叙述正确的是( )
| A. | 23g钠的原子最外层电子数为2NA | |
| B. | 1L0.1mol•L-1乙酸溶液中H+数为0.1NA | |
| C. | 标准状况下,22.4L乙烷的分子数为NA | |
| D. | 1mol甲基所含质子数为10NA |
19.下列实验操作可以达到实验目的是( )(填序号,多填扣分)
| A. | 向蔗糖溶液中加入稀硫酸,加热,冷却后加入新制Cu(OH)2检验水解产物 | |
| B. | 用酸性高锰酸钾溶液鉴别乙烷与乙烯 | |
| C. | 用饱和Na2CO3溶液除去乙酸乙酯中的少量乙酸 | |
| D. | 利用燃烧的方法鉴别羊毛和蚕丝 |
17. 某同学利用家中废旧材料制作一个可使玩具扬声器发出声音的电池、装置如图所示.下列说法正确的是( )
某同学利用家中废旧材料制作一个可使玩具扬声器发出声音的电池、装置如图所示.下列说法正确的是( )
 某同学利用家中废旧材料制作一个可使玩具扬声器发出声音的电池、装置如图所示.下列说法正确的是( )
某同学利用家中废旧材料制作一个可使玩具扬声器发出声音的电池、装置如图所示.下列说法正确的是( )| A. | 碳棒上发生的主要反应为:2H++2e-═H2↑ | |
| B. | 铝质易拉罐作为电池的正极 | |
| C. | 电池总反应为:4Al+3O2+6H2O═4Al(OH)3 | |
| D. | 电流流动方向为:铝质易拉罐→导线→扬声器→导线→碳棒→浸透食盐水的布 |
 ,甲的组成元素的原子结构示意图
,甲的组成元素的原子结构示意图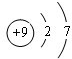 ,能证明甲的组成元素非金属性很强的事实氟气和氢气在黑暗处能产生爆炸.(任举一例即可)
,能证明甲的组成元素非金属性很强的事实氟气和氢气在黑暗处能产生爆炸.(任举一例即可)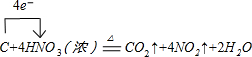 ;
;






 .
.