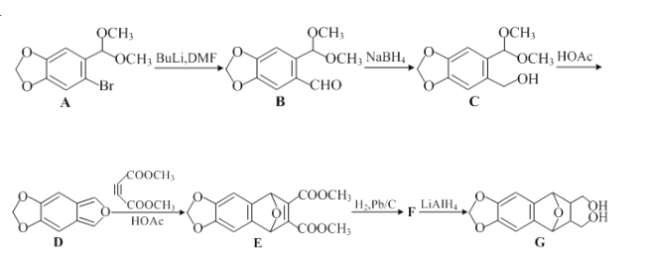
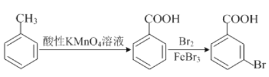
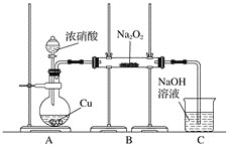
题目内容
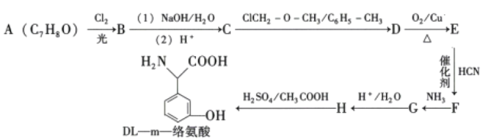
【题目】戴口罩是防控新型冠状病毒的重要手段,口罩生产的主要原料聚丙烯由丙烯聚合而来。丙烷脱氢是丙烯工业生产的重要途径,反应的热化学方程式为C3H8(g)![]() C3H6(g)+H2(g) △H>0。回答下列问题:
C3H6(g)+H2(g) △H>0。回答下列问题:
(1)从工业生产的角度来看制备丙烯所用的丙烷可以从下面工业气体中获得的是___________。
A.液化石油气 B.炼铁高炉尾气 C.水煤气 D.焦炉气
(2)104Pa、105Pa时由一定量丙烷脱氢制丙烯,反应在不同温度下达到平衡,测得丙烷、丙烯的物质的量分数变化关系如图示。
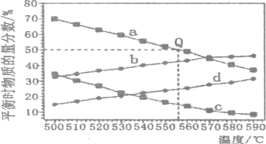
①104Pa时丙烷及丙烯的物质的量分数随温度变化关系的曲线分别是___________、___________。
②丙烷脱氢制丙烯反应在___________(选“高温”或低温”)时更加容易自发进行。
③起始时充入一定量的丙烷发生反应,计算Q点对应温度下该反应的平衡常数KP=___________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)一种丙烷脱氢制丙烯工艺生产中增加了氧化脱氢部分,O2被引入到脱氢反应体系中,这样做的好处是___________。
(4)利用CO2的弱氧化性,开发了丙烷氧化脱氢制丙烯的新工艺。其反应机理如图所示。
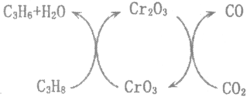
已知:CO和C3H6、C3H8的燃烧热△H分别为-283.0kJmol-1、-2049.0kJmol-1、-2217.8kJmol-1。
①298K时,该工艺总反应的热化学方程式为___________________________。
②该工艺可以有效消除催化剂表面的积炭,维持催化剂活性,原因是___________。
【答案】A c b 高温 12500Pa O2与H2反应生成H20,使脱氢反应平衡正向移动,提高丙烯转化率;丙烷脱氢反应为吸热反应,O2与H2反应放热,为脱氢反应提供热量 CO2(g)+C3H8(g)=C3H6(g)+CO(g)+H2O(l) △H=+114.2kJ·mol-1 碳和二氧化碳生成一氧化碳气体,脱离催化剂
【解析】
(1)根据工业上常用于获取烷烃的原料解答;
(2)①丙烷为反应物,丙烯是生成物,所以a、c代表丙烷的物质的量分数,b、d代表丙烯的物质的量分数,再结合压强对平衡移动的影响,进一步分析解答;
②由图像分析,温度升高,平衡正移,反应为吸热反应,吸热反应高温下更容易自发进行;
③建立三段式,结合平衡常数计算公式进行计算;
(3)结合平衡移动原理进行分析解答;
(4)根据已知,写出CO和C3H6、C3H8的燃烧热反应方程式,结合转化反应机理,得到总的反应方程式,再根据盖斯定律计算总反应方程式的反应热,碳和二氧化碳生成一氧化碳气体,脱离催化剂,可维持催化剂活性。
(1)工业上常从液化石油气中获取丙烷,故答案为:A;
(2)①正反应吸热,升高温度平衡向正反应方向进行,丙烷的含量减少,由图像分析可知,a、c代表丙烷的物质的量分数,b、d代表丙烯的物质的量分数,对于反应C3H8(g)![]() C3H6(g)+H2(g),增大压强,平衡逆向移动,丙烷的物质的量分数增大,丙烯的物质的量分数减小,所以曲线c代表104Pa时丙烷的物质的量分数随温度变化关系,曲线b代表104Pa时丙烯的物质的量分数随温度变化关系,故答案为:c;b;
C3H6(g)+H2(g),增大压强,平衡逆向移动,丙烷的物质的量分数增大,丙烯的物质的量分数减小,所以曲线c代表104Pa时丙烷的物质的量分数随温度变化关系,曲线b代表104Pa时丙烯的物质的量分数随温度变化关系,故答案为:c;b;
②因为反应吸热,所以温度越高,反应越容易自发进行,即高温时更加容易自发进行,故答案为:高温;
③由图像可得,Q点对应的压强为105Pa,平衡时丙烷的物质的量分数为50%,设起始时充入1mol丙烷,列三段式有:
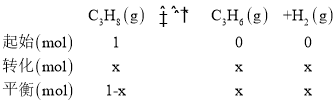
则有![]() ,解得x=
,解得x=![]() ,所以平衡常数
,所以平衡常数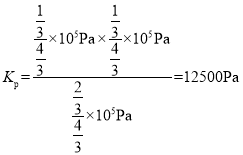 ,故答案为:12500Pa;
,故答案为:12500Pa;
(3)氧化脱氢时,可以使O2与H2反应生成H20,使脱氢反应平衡正向移动,提高丙烯转化率;同时,丙烷脱氢反应为吸热反应,O2与H2反应放热,可为脱氢反应提供热量,故答案为:O2与H2反应生成H20,使脱氢反应平衡正向移动,提高丙烯转化率;丙烷脱氢反应为吸热反应,O2与H2反应放热,为脱氢反应提供热量;
(4)①由已知CO和C3H6、C3H8的燃烧热△H分别为-283.0kJmol-1、-2049.0kJmol-1、-2217.8kJmol-1,则有:
①CO(g)+![]() O2(g)=CO2(g) ΔH=-283.0 kJmol-1
O2(g)=CO2(g) ΔH=-283.0 kJmol-1
②C3H6(g)+![]() O2(g)=3CO2(g)+3H2O(l) ΔH=-2049.0kJmol-1
O2(g)=3CO2(g)+3H2O(l) ΔH=-2049.0kJmol-1
③C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) ΔH=-2217.8kJmol-1
该反应的总反应式为CO2(g)+C3H8(g)=C3H6(g)+CO(g)+H2O(l),根据盖斯定律,反应③-①-②可得总反应,则总反应的反应热为-2217.8kJmol-1-(-2049.0kJmol-1)-(-283.0 kJmol-1)=114.2kJ·mol-1,故答案为:CO2(g)+C3H8(g)=C3H6(g)+CO(g)+H2O(l) △H=+114.2kJ·mol-1;
②由于碳和二氧化碳生成一氧化碳气体,脱离催化剂,可以有效消除催化剂表面的积炭,维持催化剂活性,故答案为:碳和二氧化碳生成一氧化碳气体,脱离催化剂。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】根据你所学习的元素周期律和周期表知识回答下列相关问题:
(1)现有部分短周期元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
T | 单质是一种淡黄色固体,是黑火药成分之一 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
Z | 元素最高正价是+7价 |
(i)元素Y的氢化物的电子式为____,其水溶液呈碱性的原因是(用电离方程式表示):____;
(ii)元素Z与元素T相比,非金属性较强的是___(填元素符号);
(iii)探寻物质的性质差异性是学习的重要方法之一,T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是___(填化学式)。
(2)下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质),把与下面元素有关的性质相符的曲线标号填入相应的空格中:
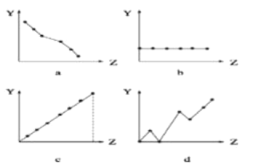
(i)IIA族元素的最外层电子数(填字母)____;
(ii)第三周期元素的最高化合价(填字母)____;
(iii)N3、O2、F、Na、Mg2、Al3的离子半径(填字母)___。
(3)周期表中某些元素化合物的易燃性、毒性变化有一定规律性,例如:
(i)氢化物的易燃性:第二周期___>__>H2O>HF,第三周期SiH4>PH3>___>___(填化学式);
(ii)化合物的毒性:PH3>NH3,H2S___H2O,CS2_CO2(选填“<”、“>”或“=”)。
【题目】下列实验装置、操作正确,且能实现相应实验目的的是:
实验装置 | 实验操作 | 实验目的 | |
A |
| 用标准KMNO4溶液滴定Na2S2O3溶液 | 测定Na2S2O3溶液浓度 |
B |
| 蒸发AlCl3溶液 | 得到AlCl3固体 |
C |
| 逐滴滴加 AgNO3 溶液 | 根据沉淀产生的先后顺序确定Ksp(A gCl)和Ksp(AgI)的大小 |
D |
| 加热 NH4Cl 固体 | 制备 NH3 |
A.AB.BC.CD.D