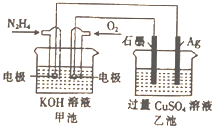
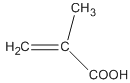
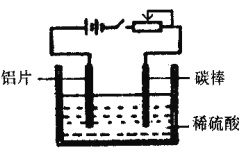
题目内容
【题目】2SO2(g)十O2(g)![]() 2SO3(g) △H = -198kJ·mol-1,在V2O5存在时,该反应机理为:
2SO3(g) △H = -198kJ·mol-1,在V2O5存在时,该反应机理为:
Ⅰ:V2O5+ SO2→2VO2 +SO3(快) Ⅱ: 4VO2+O2→2V2O5(慢),下列说法正确的是( )
A. 反应速率主要取决于Ⅰ步反应
B. 该反应逆反应的活化能大于198kJ/mol
C. 2molSO2和1molO2在一定条件下充分反应能放出198KJ的热量
D. 在恒温、恒容条件下,达到平衡后继续加入少量SO3平衡将向正反应方向移动,所以SO3的体积百分数增大
【答案】B
【解析】对于多步反应,决定总反应速率的应该是较慢的反应,所以反应速率主要取决于Ⅱ步反应,选项A错误。该反应为放热反应,其能量变化可以表示为下图:
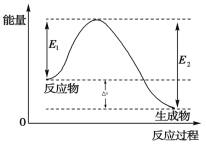
则E1为正反应活化能,E2为逆反应活化能,焓变△H为-198kJ·mol-1,所以该反应逆反应的活化能大于198kJ/mol,选项B正确。该反应为可逆反应,2molSO2和1molO2在一定条件下反应,是不能完全反应的,所以放热一定小于198KJ,选项C错误。加入少量SO3(即增大生成物浓度)平衡应该向逆反应方向进行,选项D错误。

【题目】下列有关实验操作、现象和解释或结论都正确的是
选项 | 实验操作 | 现象 | 解释或结论 |
A | 将Na2CO3溶液由0.1mol/L 稀释到0.01mol/L,测溶渡pH | 溶液pH变小 | 稀释后CO32-的水解程度减小 |
B | 向一定浓度的CuSO4溶液中 通入适量的H2S气体 | 出现黑色沉淀 | H2S的酸性比H2SO4强 |
C | 将盛有棕红色NO2气体的注射 器由10 mL 压缩至5 mL | 气体颜色比压 缩前变浅 | 反应2NO2 |
D | 在新生成的AgCl 沉淀中滴入 稀KI溶液,振荡 | 白色沉淀转化为 黄色沉淀 | Ksp (AgCl )>Ksp (AgI) |
A. A B. B C. C D. D
【题目】已知反应A(g)+B(g) ![]() C(g)+D(g)的平衡常数K值与温度的关系如表所示,830 ℃时,向一个2 L的密闭容器中充入0.20 mol A和0.20 mol B,10 s时达平衡。下列说法不正确的是
C(g)+D(g)的平衡常数K值与温度的关系如表所示,830 ℃时,向一个2 L的密闭容器中充入0.20 mol A和0.20 mol B,10 s时达平衡。下列说法不正确的是
温度/℃ | 700 | 830 | 1200 |
K值 | 1.7 | 1.0 | 0.4 |
A. 达到平衡后,B的转化率为50%
B. 增大压强,正、逆反应速率均加快
C. 该反应为吸热反应,升高温度,平衡正向移动
D. 反应初始至平衡,A的平均反应速率v(A)=0.005 mol·L-1·s-1