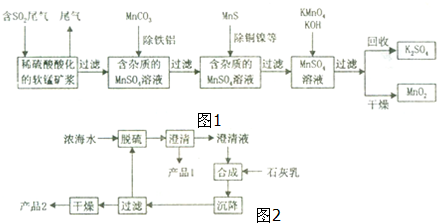
题目内容
3. W、M、X、Y、Z五种短周期元素在周期表中的位置如表所示,其中只有M为金属元素.请回答下列问题:
W、M、X、Y、Z五种短周期元素在周期表中的位置如表所示,其中只有M为金属元素.请回答下列问题:| W | ||||
| M | X | Y | Z |
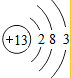 ,比较Y与Z两种元素的简单离子的半径大小:S2->Cl-(用离子符号表示)
,比较Y与Z两种元素的简单离子的半径大小:S2->Cl-(用离子符号表示)(2)写出X的氧化物与W的氢化物的水溶液反应的化学方程式:SiO2+4HF=SiF4↑+2H2O.
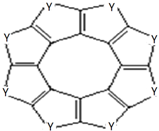
(3)科学家研制出一种英文名为sulflower的新型分子C16Y8(结构如图所示).1mol C16Y8最多能与8mol H2发生加成反应.
(4)托帕石是一种名贵黄玉,其组成为M2[XO4]WOH,托帕在强碱溶液中会发生腐蚀,写出托帕石粉末与过量NaOH溶液反应的化学方程式:Al2[SiO4]FOH+5NaOH=2NaAlO2+Na2SiO3+NaF+3H2O.
分析 根据题意:其中只有M为金属元素,所以M是Al,X是Si,Y是S,Z是Cl,W是F.
(1)根据原子核外电子排布规律来确定电子排布示意图,微粒电子层越多半径越大,电子层数一样,核电荷数越多,半径越小;
(2)二氧化硅可以和氢氟酸之间反应生成四氟化硅和水;
(3)根据双键的数目结合加成反应的特征来回答;
(4)托帕石粉末与过量NaOH溶液反应偏铝酸钠、硅酸钠、氟化钠以及水,根据质量守恒来配平方程式.
解答 解:根据题意:其中只有M为金属元素,所以M是Al,X是Si,Y是S,Z是Cl,W是F.
(1)根据原子核外电子排布规律,Al原子的核外电子排布示意图为 ,硫离子和氯离子电子层数一样,核电荷数越多,半径越小,所以微粒半径:S2->Cl-;故答案为:
,硫离子和氯离子电子层数一样,核电荷数越多,半径越小,所以微粒半径:S2->Cl-;故答案为: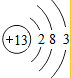 ;S2->Cl-;
;S2->Cl-;
(2)硅的氧化物与F的氢化物的水溶液反应生成四氟化硅和水,即SiO2+4HF=SiF4↑+2H2O;故答案为:SiO2+4HF=SiF4↑+2H2O;
(3)1mol C16Y8双键的数目是8mol,所以最多能与 8molH2发生加成反应;故答案为:8;
(4)根据推断结果,M2[XO4]WOH的分子式为:Al2[SiO4]FOH,托帕石粉末与过量NaOH溶液反应偏铝酸钠、硅酸钠、氟化钠以及水,根据质量守恒来配平方程式为:
Al2[SiO4]FOH+5NaOH=2NaAlO2+Na2SiO3+NaF+3H2O;故答案为:Al2[SiO4]FOH+5NaOH=2NaAlO2+Na2SiO3+NaF+3H2O.
点评 本题涉及元素周期表的结构以及元素周期律的应用知识,属于综合知识的考查,难度中等.

练习册系列答案
相关题目
13.X、Y、Z均为短周期元素,它们的原子核外最外层电子数分别为1、6、6.Z位于Y的上一周期,则这三种元素形成的某种化合物的化学式可能为( )
| A. | X3YZ4 | B. | X2YZ3 | C. | X2YZ4 | D. | XY2Z3 |
14.以金红石(主要成分TiO2)为原料生产金属钛的主要步骤是:
①在高温下,向金红石与焦炭的混合物中通入Cl2,得到TiCl4和一种可燃气体;
②在稀有气体(如氩)氛围和加热的条件下,用镁与TiCl4反应可得到钛.
下列说法不正确的是( )
①在高温下,向金红石与焦炭的混合物中通入Cl2,得到TiCl4和一种可燃气体;
②在稀有气体(如氩)氛围和加热的条件下,用镁与TiCl4反应可得到钛.
下列说法不正确的是( )
| A. | 反应①、②均为氧化还原反应 | |
| B. | 在反应①中金红石和焦炭均为还原剂 | |
| C. | 反应①中可燃性气体是CO | |
| D. | 反应②中有1molTi生成时,转移4mol e- |
18.将下列物质注入水中,振荡后静置,能分层且浮于水面上的是( )
| A. | 溴苯 | B. | 苯 | C. | 乙醇 | D. | 硝基苯 |
8.下列说法不正确的是( )
| A. | 用SO2漂白食品 | B. | 用硅制作太阳能电池 | ||
| C. | 工业上用氮气和氢气合成氨 | D. | 漂白粉可用于杀菌消毒 |
12.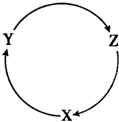 下表各组物质之间通过一步反应不能实现如图所示转化的是( )
下表各组物质之间通过一步反应不能实现如图所示转化的是( )
 下表各组物质之间通过一步反应不能实现如图所示转化的是( )
下表各组物质之间通过一步反应不能实现如图所示转化的是( )| 选项 | X | Y | Z |
| A | SO2 | SO3 | H2SO4 |
| B | NaOH | Na2CO3 | Na2SO4 |
| C | Si | SiO2 | H2SiO3 |
| D | NO | NO2 | HNO3 |
| A. | A | B. | B | C. | C | D. | D |
6.可以将六种无色液体:C2H5OH、C6H6、AgNO3溶液,NaOH溶液、KI溶液、C6H5OH溶液,区分开的试剂是( )
| A. | 碘水 | B. | 淀粉溶液 | C. | FeCl3溶液 | D. | 新制氢氧化铜 |