题目内容
17.180g硫铁矿(二硫化亚铁)在空气中完全燃烧,收集生成的二氧化硫气体在标准状况下占多少升?生成三氧化二铁多少克?分析 二硫化亚铁在空气中完全燃烧反应方程式为4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,180g二硫化亚铁的物质的量=$\frac{180g}{120g/mol}$1.5mol,根据二硫化亚铁和二氧化硫、氧化铁之间的关系式计算生成二氧化硫体积、氧化铁质量,据此分析解答.
解答 解:二硫化亚铁在空气中完全燃烧反应方程式为4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,180g二硫化亚铁的物质的量=$\frac{180g}{120g/mol}$1.5mol,
设生成二氧化硫在标况下气体是x、生成氧化铁质量是y,
4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,
4mol 320g (22.4×8)L
1.5mol y x
4mol:(22.4×8)L=1.5mol:x
x=$\frac{(22.4×8)L×1.5mol}{4mol}$=67.2L
4mol:320g=1.5mol:y
y=$\frac{320g×1.5mol}{4mol}$=120g,
答:收集生成的二氧化硫气体在标准状况下占67.2升、生成三氧化二铁120克.
点评 本题考查化学方程式有关计算,为高频考点,明确各个物理量之间关系是解本题关键,题目难度不大.

练习册系列答案
相关题目
7.己烷雌酚的一种合成路线如下:
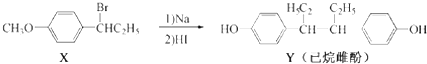
已知:连有四个不相同的原子或原子团的碳原子叫做手性碳原子.下列叙述正确的是( )

已知:连有四个不相同的原子或原子团的碳原子叫做手性碳原子.下列叙述正确的是( )
| A. | Y的分子式为C18H20O2 | |
| B. | 在一定条件,化合物Y可与HCHO发生缩聚反应 | |
| C. | 在NaOH水溶液中加热,化合物X可发生消去反应 | |
| D. | 化合物Y中不含有手性碳原子 |
8.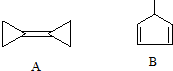 有机化学中的结构可用键线式表示,如CH2=CHCH2Br可表示为
有机化学中的结构可用键线式表示,如CH2=CHCH2Br可表示为 .下列关于两种有机化合物A和B的说法中错误的是( )
.下列关于两种有机化合物A和B的说法中错误的是( )
 有机化学中的结构可用键线式表示,如CH2=CHCH2Br可表示为
有机化学中的结构可用键线式表示,如CH2=CHCH2Br可表示为 .下列关于两种有机化合物A和B的说法中错误的是( )
.下列关于两种有机化合物A和B的说法中错误的是( )| A. | 有机物A分子所有碳原子杂化形式有:sp3和sp2两种 | |
| B. | 有机物B的化学式为C6H8 | |
| C. | 有机物B的一氯取代产物有4种 | |
| D. | 等质量的A和B完全燃烧耗氧量不同 |
5.下列关于物质的量的说法不正确的是( )
| A. | 物质的量的单位是mol | |
| B. | 物质的量和时间一样,也是一种物理量 | |
| C. | 通过物质的量建立起宏观数量和微观粒子数量的联系 | |
| D. | 物质的量大的物质所占体积一定就大于物质的量小的物质 |
12.下列实验方案最合理的是( )
| A. | 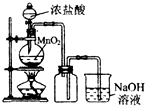 制备并收集Cl2 | B. |  制备氨气 | ||
| C. | 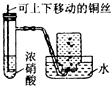 制备并收集NO2气体 | D. |  制备氧气 |