题目内容
11.下列实验不能作为判断依据的是( )| A. | 碳酸钠溶液显碱性,硫酸钠溶液显中性,判断碳与硫的非金属性强弱 | |
| B. | Cl2与Br2分别和H2反应,判断氯与溴的非金属性强弱 | |
| C. | 在MgSO4与Al(NO3)3溶液中分别加入过量的氨水,判断镁与铝的金属性强弱 | |
| D. | 钠和钾分别与冷水反应,判断钠和钾的金属性强弱 |
分析 A.根据盐类的水解程度可比较酸性的强弱,最高价含氧酸的酸性越强,元素的非金属性越强;
B.非金属性越强,其单质与氢气化合越容易;
C.氢氧化镁和氢氧化铝均不溶于氨水;
D.金属与水反应越剧烈,金属性越强.
解答 解:A.碳酸钠溶液显碱性,硫酸钠溶液显中性,说明酸性硫酸大于碳酸,最高价含氧酸的酸性越强,元素的非金属性越强,所以能判断碳与硫的非金属性强弱,故A正确;
B.非金属性越强,其单质与氢气化合越容易,Cl2与Br2分别和H2反应,能判断氯与溴的非金属性强弱,故B正确;
C.氢氧化镁和氢氧化铝均不溶于氨水,不能判断两种物质的碱性强弱,所以不能判断镁与铝的金属性强弱,故C错误;
D.金属与水反应越剧烈,金属性越强,钠和钾分别与冷水反应,钾反应更剧烈,所以能判断钠和钾的金属性强弱,故D正确.
故选C.
点评 本题考查较为综合,涉及金属性、非金属性的强弱的比较,侧重于学生的分析能力、实验能力的考查,注意把握实验的严密性和可行性的评价,难度不大.

练习册系列答案
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案
相关题目
1.设NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 含NA个Na+的Na2OH溶解于1L水中,Na+浓度为1mol•L-1 | |
| B. | 常温常压下,11.2LH2 中含有分分子数大于0.5NA | |
| C. | 常温常压下,30.8gCCl4中含有的原子数目为NA | |
| D. | 2L0.5mol•L-1H2O2溶液中含有的氧原子数为2NA |
19. 甲醇是重要的化工原料,又可称为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
甲醇是重要的化工原料,又可称为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)?CH3OH(g)△H1
②CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H2
③CO2(g)+H2(g)?CO(g)+H2O(g)△H3
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:(其中CO中的碳氧键为C$\frac{\underline{\;←\;}}{\;}$O)
由此计算△H1=-99kJ•mol-1,已知△H2=-58kJ•mol-1,则△H3=+41kJ•mol-1.
(2)在25℃、101KPa下,每充分燃烧1g CH3OH并恢复到原状态,会释放22.68KJ的热量.请写出表示甲醇燃烧热的热化学反应方程式:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-725.76kJ•mol-1.
(3)利用CO2与H2反应还可合成二甲醚(CH3OCH3).以KOH为电解质溶液,组成二甲醚空气燃料电池,该电池工作时其负极反应式是CH3OCH3-12e-+16OH-=2CO32-+11H2O.
(4)常温下,用二甲醚燃料电池电解600mL NaCl溶液,若消耗二甲醚0.23g,两极共产生气体1.344L(标准状况),溶液的pH=13.
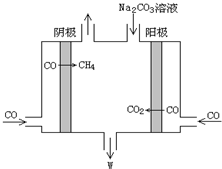
(5)若用二甲醚燃料电池电解CO制备CH4和W,工作原理如图所示,生成物WNaHCO3是,其电解总离子方程式是4CO+3CO32-+5H2O=6HCO3-+CH4↑.
 甲醇是重要的化工原料,又可称为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
甲醇是重要的化工原料,又可称为燃料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:①CO(g)+2H2(g)?CH3OH(g)△H1
②CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H2
③CO2(g)+H2(g)?CO(g)+H2O(g)△H3
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:(其中CO中的碳氧键为C$\frac{\underline{\;←\;}}{\;}$O)
| 化学键 | H-H | C-O | C$\frac{\underline{\;←\;}}{\;}$O | H-O | C-H |
| E/(kJ.mol-1) | 436 | 343 | 1076 | 465 | 413 |
(2)在25℃、101KPa下,每充分燃烧1g CH3OH并恢复到原状态,会释放22.68KJ的热量.请写出表示甲醇燃烧热的热化学反应方程式:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-725.76kJ•mol-1.
(3)利用CO2与H2反应还可合成二甲醚(CH3OCH3).以KOH为电解质溶液,组成二甲醚空气燃料电池,该电池工作时其负极反应式是CH3OCH3-12e-+16OH-=2CO32-+11H2O.
(4)常温下,用二甲醚燃料电池电解600mL NaCl溶液,若消耗二甲醚0.23g,两极共产生气体1.344L(标准状况),溶液的pH=13.
(5)若用二甲醚燃料电池电解CO制备CH4和W,工作原理如图所示,生成物WNaHCO3是,其电解总离子方程式是4CO+3CO32-+5H2O=6HCO3-+CH4↑.
6.下列事实不能用有机物分子内基团间的相互作用解释的是( )
| A. | 苯在50℃~60℃时发生硝化反应而甲苯在30℃时即可 | |
| B. | 苯酚能跟NaOH溶液反应而乙醇不能 | |
| C. | 甲苯能使KMnO4酸性溶液褪色而乙烷不能 | |
| D. | 乙烯能发生加成反应而乙烷不能 |
16.下列叙述正确的是( )
| A. | CO2的水溶液可以导电,CO2是电解质 | |
| B. | 硫酸钡难溶于水,但却是电解质 | |
| C. | 氯化钠溶液在电流的作用下电离成钠离子和氯离子 | |
| D. | 溶于水后能电离出氢离子的化合物都是酸 |
3.若以ω1和ω2分别表示浓度为a mol/L和b mol/L硫酸溶液的质量分数,且知2a=b,则 下列推断中,正确的是( )
| A. | 2ω1=ω2 | B. | 2ω2=ω1 | C. | ω2>2ω1 | D. | ω1<ω2<2ω1 |
1.下列各溶液中,Na+浓度最大的是( )
| A. | 4 L 0.3 mol•L-1的NaCl溶液 | B. | 1 L 0.25 mol•L-1的Na2SO4溶液 | ||
| C. | 0.8 L 0.4 mol•L-1的NaOH溶液 | D. | 2 L 0.2 mol•L-1的Na3PO4溶液 |
 高炉炼铁中发生的基本反应之一:FeO(s)+CO(g)?Fe(s)+CO2(g);正反应吸热
高炉炼铁中发生的基本反应之一:FeO(s)+CO(g)?Fe(s)+CO2(g);正反应吸热