题目内容
2. 高炉炼铁中发生的基本反应之一:FeO(s)+CO(g)?Fe(s)+CO2(g);正反应吸热
高炉炼铁中发生的基本反应之一:FeO(s)+CO(g)?Fe(s)+CO2(g);正反应吸热(l)已知1100℃时 K=0.263.应该反应化学平衡常数的表达式为$\frac{c(CO{\;}_{2})}{c(CO)}$,温度升高,化学平衡移动后达到新的平衡,平衡常数K值增大.(填增大、减小或不变)
(2)1100℃时测得高炉中 c(CO2)=0.025mol/L,c(CO)=0.1mol/L,此时化学反应速率是v(正)>v(逆)(填=、>或<)
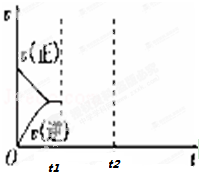
(3)在如图中画出在某时刻条件改变后的图象(其他条件不变).t1:增大CO的浓度 t2:降低温度.
分析 (1)平衡常数等于生成物浓度系数次幂之积除以反应物浓度系数次幂之积,该反应正反应是吸热反应,温度升高平衡向正反应方向移动,据此判断;
(2)计算此时的浓度商Qc,与平衡常数比较判断反应进行方向;
(3)t1:增大CO的浓度,瞬间正反应速率增大、逆反应速率不变,平衡向正反应方向移动;
t2:降低温度,瞬间正、逆反应速率都低于增大CO的浓度到达平衡时的速率,正反应为吸热反应,平衡向逆反应方向移动,正反应速率降低更大,据此作图.
解答 解:(1)根据平衡常数的定义可知,反应化学平衡常数的表达式为$\frac{c(CO{\;}_{2})}{c(CO)}$,该反应正反应是吸热反应,温度升高平衡向正反应方向移动,CO2的物质的量增大、CO的物质的量减小,故到达新平衡是CO2与CO的体积之比增大,平衡常数k增大,
故答案为:$\frac{c(CO{\;}_{2})}{c(CO)}$;增大;
(2)此时浓度商Qc=$\frac{0.025}{0.1}$=0.25,小于平衡常数2.63,故反应不是平衡状态,反应向正反应进行,v(正)>v(逆),
故答案为:>;
(3)t1:增大CO的浓度,瞬间正反应速率增大、逆反应速率不变,平衡向正反应方向移动;
t2:降低温度,瞬间正、逆反应速率都低于增大CO的浓度到达平衡时的速率,正反应为吸热反应,平衡向逆反应方向移动,正反应速率降低更大,图象为: ,
,
故答案为: .
.
点评 本题考查化学平衡的影响因素、化学平衡常数、反应方向的判断等,侧重对基础知识的巩固利用,难度中等,(3)中作图注意改变条件瞬间速率变化.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
13.常温下,下列有关叙述正确的是( )
| A. | NaB溶液的pH=8,c(Na+)-c(B-)=9.9×10-7mol/L | |
| B. | Na2CO3溶液中,2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| C. | pH相等的①NH4NO3、②(NH4)2SO4、③NH4HSO4三种溶液中,c(NH4+)大小顺序为:①>②>③ | |
| D. | 10mL pH=12的氢氧化钠溶液中加入pH=2的HA溶液至pH刚好等于7,则所得溶液体积V(总)=20mL |
10.下列说法正确的是( )
| A. | 凡是化合反应都是放热反应,分解反应都是吸热反应 | |
| B. | 热化学方程式中,如果没有注明温度和压强,则表示在标准状况下测得的数据 | |
| C. | 热化学方程式中,化学式前面的化学计量数既可表示微粒数,又可表示物质的量 | |
| D. | 书写热化学方程式时,不仅要写明反应热的符号、数值和单位,还要注明各物质的聚集状态 |
11.下列实验不能作为判断依据的是( )
| A. | 碳酸钠溶液显碱性,硫酸钠溶液显中性,判断碳与硫的非金属性强弱 | |
| B. | Cl2与Br2分别和H2反应,判断氯与溴的非金属性强弱 | |
| C. | 在MgSO4与Al(NO3)3溶液中分别加入过量的氨水,判断镁与铝的金属性强弱 | |
| D. | 钠和钾分别与冷水反应,判断钠和钾的金属性强弱 |
12.是一种重要的抗生素类药,有阻止多种细菌生长的功能,该药物是( )
| A. | 阿司匹林(乙酰水杨酸) | B. | 青霉素 | ||
| C. | 抗酸药(氢氧化铝) | D. | 麻黄碱 |
