题目内容
【题目】某校兴趣小组的同学围绕Fe3+和S2-的反应,产生了激烈的争辩,请你帮助他们完成相应的记录
(1)甲同学认为,类似于Fe3+和I-,Fe3+和S2-也能发生氧化还原反应。其中,甲同学提到的Fe3+和I-发生反应的离子方程式是______。
(2)乙同学认为甲同学考虑欠周,他认为Fe3+和S2-发生反应的离子方程式可能跟滴加顺序有关。如果是向氯化铁溶液中逐滴加入硫化钠溶液,离子方程式类似于(1)中的离子方程式;如果是向硫化钠溶液中逐滴加入氯化铁溶液,离子方程式则有所不同,应该为______。
(3)丙同学的看法与甲,乙两位同学都不同,既然类比,他更倾向于与![]() 和
和![]() 的反应类比。这样说来,丙同学预期的Fe3+和S2-发生反应的离子方程式应为______。
的反应类比。这样说来,丙同学预期的Fe3+和S2-发生反应的离子方程式应为______。
(4)丁、戊和己三位同学急了,相约来到了实验室。其中丁同学是这样做的实验:称取______gFeCl3固体置于烧杯中,用______溶解,再加适量水配成100 mL溶液备用。取2 mL1 mol/L的FeCl3溶液于试管中,逐滴滴加0.1 mol/L的Na2S溶液。开始局部产生少量的黑色沉淀,振荡,黑色沉淀立即消失(若不振荡,黑色沉淀慢慢消失),同时溶液呈浅黄色浑浊,且有少量的红褐色絮状沉淀产生,闻到轻微的臭鸡蛋气味;滴加到5滴Na2S溶液时,溶液开始出现少量的蓝黑色沉淀,振荡,沉淀不消失;继续滴加Na2S溶液,产生大量沉淀。戊同学所做的实验跟丁同学所做的实验只在滴加顺序上存在不同,刚好形成补充。简述戊同学的实验操作______。
(5)已同学将戊同学在实验过程中得到的黑色沉淀A,连同实验室现有的FeS药品(分析纯)一起,做了三个小实验。
实验内容 | 实验现象 |
①A+H2O | 无明显现象,即便加热至沸腾,沉淀也不溶解,溶液颜色也不改变,更没有臭鸡蛋气味的气体生成 |
②A+HCl | 黑色沉淀溶解,并出现大量浅黄色沉淀,伴随有臭鸡蛋气味的气体生成 |
③FeS+HCl | 生成大量臭鸡蛋气味的气体,但没有浅黄色沉淀生成 |
根据已同学的实验可知,黑色沉淀A可能为______![]() 填化学式
填化学式![]() ;它在中性或碱性溶液中能稳定存在。据此可知向硫化钠溶液中加入少量氯化铁溶液的离子方程式可能为______。
;它在中性或碱性溶液中能稳定存在。据此可知向硫化钠溶液中加入少量氯化铁溶液的离子方程式可能为______。
【答案】2Fe3++2I-=2Fe2++I2 2Fe3++3S2-=2FeS↓+S↓ 2Fe3++3S2-+6H2O═2Fe(OH)3↓+3H2S↑ 1.6 盐酸 取2 mL0.1 mol/L的Na2S溶液于试管中,逐滴滴加0.1 mol/L的FeCl3溶液 Fe2S3 2Fe3++3S2-=Fe2S3↓
【解析】
(1)碘离子和铁离子发生氧化还原反应生成碘单质;
(2)如果是向硫化钠溶液中逐滴加入氯化铁溶液,铁离子氧化硫离子生成单质硫,铁离子被还原为亚铁离子会结合硫离子生成难溶的硫化亚铁沉淀;
(3)倾向于与Al3+和S2-的反应类比,丙同学预期的Fe3+和S2-发生双水解反应生成氢氧化铁和硫化氢;
(4)配成100 mL0.1 mol/L的FeCl3溶液,需要溶质氯化铁物质的量=0.100 L×0.1 mol/L=0.01 mol,质量=0.01 mol×162.5 g/mol=1.625 g,托盘天平精确度0.1g,为防止氯化铁水溶液中水解生成氢氧化铁,需要加入盐酸抑制其水解,戊同学所做的实验跟丁同学所做的实验只在滴加顺序上存在不同,是氯化铁溶液滴入硫化钠溶液中观察反应现象;
(5)①A+H2O无明显现象,即便加热至沸腾,沉淀也不溶解,溶液颜色也不改变,更没有臭鸡蛋气味的气体生成,说明和水不反应;
②A+HCl黑色沉淀溶解,并出现大量浅黄色沉淀为S单质,伴随有臭鸡蛋气味的气体生成为H2S气体,说明固体A和盐酸生成硫化氢气体同时存在铁离子氧化硫离子生成硫单质,反应的离子方程式是Fe2S3+4H+=2Fe2++S↓+2H2S↑,
③FeS+HCl生成大量臭鸡蛋气味的气体,但没有浅黄色沉淀生成说明发生的是复分解反应生成氯化亚铁和硫化氢气体,
Na2S溶液呈碱性,FeCl3溶液与其反应不生成Fe(OH)3而生成Fe2S3的可能原因是Fe2S3的溶解度比Fe(OH)3更小,FeCl3溶液和Na2S溶液反应的产物与试剂的相对用量、反应体系的酸碱性有关,黑色沉淀A可能为Fe2S3。
(1)Fe3+和I-发生反应的离子方程式:2Fe3++2I-=2Fe2++I2;
(2)如果是向氯化铁溶液中逐滴加入硫化钠溶液,离子方程式为:2Fe3++S2-=2Fe2++S,如果是向硫化钠溶液中逐滴加入氯化铁溶液,离子方程式则有所不同,应该为:2Fe3++3S2-=2FeS↓+S↓;
(3)倾向于与Al3+和S2-的反应类比,丙同学预期的Fe3+和S2-发生双水解反应生成氢氧化铁和硫化氢,反应的离子方程式:2Fe3++3S2-+6H2O═2Fe(OH)3↓+3H2S↑;
(4)配成100 mL0.1 mol/L的FeCl3溶液,需要溶质氯化铁物质的量=0.100 L×0.1 mol/L=0.01 mol,质量=0.01 mol×162.5 g/mol=1.625 g,托盘天平精确度0.1g,称取1.6g氯化铁固体配制溶液0.1 mol/L100 ml氯化铁溶液,为防止氯化铁水溶液中水解生成氢氧化铁,需要加入盐酸抑制其水解,戊同学所做的实验跟丁同学所做的实验只在滴加顺序上存在不同,是氯化铁溶液滴入硫化钠溶液中观察反应现象,取2 mL0.1 mol/L的Na2S溶液于试管中,逐滴滴加0.1 mol/L的FeCl3溶液,
(5)①A+H2O无明显现象,即便加热至沸腾,沉淀也不溶解,溶液颜色也不改变,更没有臭鸡蛋气味的气体生成,说明和水不反应,
②A+HCl黑色沉淀溶解,并出现大量浅黄色沉淀为S单质,伴随有臭鸡蛋气味的气体生成为H2S气体,说明固体A和盐酸生成硫化氢气体同时存在铁离子氧化硫离子生成硫单质,反应的离子方程式是Fe2S3+4H+=2Fe2++S↓+2H2S↑,
③FeS+HCl生成大量臭鸡蛋气味的气体,但没有浅黄色沉淀生成说明发生的是复分解反应生成氯化亚铁和硫化氢气体,
Na2S溶液呈碱性,FeCl3溶液与其反应不生成Fe(OH)3而生成Fe2S3的可能原因是Fe2S3的溶解度比Fe(OH)3更小,FeCl3溶液和Na2S溶液反应的产物与试剂的相对用量、反应体系的酸碱性有关,黑色沉淀A可能为Fe2S3,据此可知向硫化钠溶液中加入少量氯化铁溶液的离子方程式可能为:2Fe3++3S2-=Fe2S3↓。

【题目】工业上利用电解饱和食盐水来制取烧碱,所用的食盐水需两次精制。第一次精制主要是用沉淀法除去粗盐水中Ca2+、Mg2+、Fe3+、SO42-等离子,过程如下:
Ⅰ.向粗盐水中加入过量BaCl2溶液,过滤;
Ⅱ.向所得滤液中加入过量Na2CO3溶液,过滤;
Ⅲ.用盐酸调节滤液的pH,获得一次精制盐水。
(1)过程Ⅰ中除去的离子是______。
(2)表是过程Ⅰ、Ⅱ中生成的部分沉淀及其在20℃时的溶解度(g/100 gH2O):
CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 | Fe(OH)3 |
2.6×10-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 | 4.8×10-9 |
运用表中信息回答下列问题:
①过程Ⅱ中生成的主要沉淀除CaCO3和Mg2(OH)2CO3外还有______。
②过程Ⅰ选用的是BaCl2而不选用CaCl2,原因是______。
③除去Mg2+的离子方程式是______。
④检测Ca2+、Mg2+、Ba2+是否除尽时,只需检测Ba2+即可,原因是______。
(3)第二次精制要除去微量的I-、IO3-、NH4+、Ca2+、Mg2+,流程示意图如图:

①过程Ⅳ除去的离子是______。
②盐水b中含有SO42-,Na2S2O3将IO3-还原为I2的离子方程式是______。
③在过程Ⅴ中所用的Na2S2O3俗称海波,是一种重要的化工原料。商品海波主要成分是Na2S2O3·5H2O为了测定其含Na2S2O3·5H2O的纯度,称取8.00 g样品,配制成250.0 mL溶液,取25.00 mL于锥形瓶中,滴加淀粉溶液作指示剂,再用浓度为0.0500 mol/L的碘水滴定(发生反应2S2O32-+I2=S4O62-+2I-),滴定达到终点时的现象是______。下表记录滴定结果:
滴定次数 | 滴定前读数(mL) | 滴定滴定后读数(mL) |
第一次 | 0.30 | 31.12 |
第二次 | 0.36 | 31.56 |
第三次 | 1.10 | 31.88 |
计算样品的纯度为______。
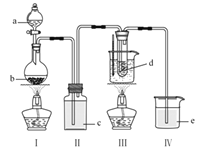
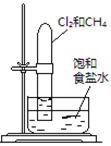
【题目】下述实验方案能达到实验目的的是 ( )
编号 | A | B | C | D |
实验 |
|
|
|
|
实验 | 验证铁钉发生 | 验证Fe电极被保护 | 验证乙炔的还原性 | 验证甲烷与氯气发生 |
A.AB.BC.CD.D