题目内容
【题目】下述实验方案能达到实验目的的是 ( )
编号 | A | B | C | D |
实验 |
|
|
|
|
实验 | 验证铁钉发生 | 验证Fe电极被保护 | 验证乙炔的还原性 | 验证甲烷与氯气发生 |
A.AB.BC.CD.D
【答案】D
【解析】
A.析氢腐蚀是在酸性条件下发生的,在食盐水为中性,发生吸氧腐蚀,A错误;
B.金属铁做电解池的阳极,更易失电子,金属被强烈腐蚀,无法被保护,B错误;
C.因为电石是混合物,与水反应时生成的乙炔气体中含有H2S气体,也具有还原性,也能使酸性高锰酸钾溶液褪色,所以必须除杂后才能通过酸性高锰酸钾溶液验证乙炔的还原性,C错误;
D.甲烷与Cl2发生取代反应,生成HCl和多种氯化反应,可观察到试管中有白雾和油状液体生成,此证明甲烷与氯气发生取代反应,D正确;
答案选D。

【题目】某校兴趣小组的同学围绕Fe3+和S2-的反应,产生了激烈的争辩,请你帮助他们完成相应的记录
(1)甲同学认为,类似于Fe3+和I-,Fe3+和S2-也能发生氧化还原反应。其中,甲同学提到的Fe3+和I-发生反应的离子方程式是______。
(2)乙同学认为甲同学考虑欠周,他认为Fe3+和S2-发生反应的离子方程式可能跟滴加顺序有关。如果是向氯化铁溶液中逐滴加入硫化钠溶液,离子方程式类似于(1)中的离子方程式;如果是向硫化钠溶液中逐滴加入氯化铁溶液,离子方程式则有所不同,应该为______。
(3)丙同学的看法与甲,乙两位同学都不同,既然类比,他更倾向于与![]() 和
和![]() 的反应类比。这样说来,丙同学预期的Fe3+和S2-发生反应的离子方程式应为______。
的反应类比。这样说来,丙同学预期的Fe3+和S2-发生反应的离子方程式应为______。
(4)丁、戊和己三位同学急了,相约来到了实验室。其中丁同学是这样做的实验:称取______gFeCl3固体置于烧杯中,用______溶解,再加适量水配成100 mL溶液备用。取2 mL1 mol/L的FeCl3溶液于试管中,逐滴滴加0.1 mol/L的Na2S溶液。开始局部产生少量的黑色沉淀,振荡,黑色沉淀立即消失(若不振荡,黑色沉淀慢慢消失),同时溶液呈浅黄色浑浊,且有少量的红褐色絮状沉淀产生,闻到轻微的臭鸡蛋气味;滴加到5滴Na2S溶液时,溶液开始出现少量的蓝黑色沉淀,振荡,沉淀不消失;继续滴加Na2S溶液,产生大量沉淀。戊同学所做的实验跟丁同学所做的实验只在滴加顺序上存在不同,刚好形成补充。简述戊同学的实验操作______。
(5)已同学将戊同学在实验过程中得到的黑色沉淀A,连同实验室现有的FeS药品(分析纯)一起,做了三个小实验。
实验内容 | 实验现象 |
①A+H2O | 无明显现象,即便加热至沸腾,沉淀也不溶解,溶液颜色也不改变,更没有臭鸡蛋气味的气体生成 |
②A+HCl | 黑色沉淀溶解,并出现大量浅黄色沉淀,伴随有臭鸡蛋气味的气体生成 |
③FeS+HCl | 生成大量臭鸡蛋气味的气体,但没有浅黄色沉淀生成 |
根据已同学的实验可知,黑色沉淀A可能为______![]() 填化学式
填化学式![]() ;它在中性或碱性溶液中能稳定存在。据此可知向硫化钠溶液中加入少量氯化铁溶液的离子方程式可能为______。
;它在中性或碱性溶液中能稳定存在。据此可知向硫化钠溶液中加入少量氯化铁溶液的离子方程式可能为______。
【题目】绿水青山就是金山銀山,生产生活中污染物的合理处理对环境保护具有重要意义。
(1)利用某些催化剂,成功实现将空气中的碳氧化合物和氮氧化合物转化为无毒的大气循环物质。
已知:①![]()
![]()
②NO(g)+CO(g)![]()
![]() N2(g)+CO2(g)
N2(g)+CO2(g)![]()
③2NO(g)+O2(g)![]() 2NO2(g)
2NO2(g) ![]()
反应![]() 的
的![]() ________
________![]() ;某温度下,反应①②③的平衡常数分別カ
;某温度下,反应①②③的平衡常数分別カ![]() 、
、![]() 、
、![]() ,则该反应的K=________(用
,则该反应的K=________(用![]() 、
、![]() 、
、![]() 表示)。
表示)。
(2)温度为![]() ℃吋,在四个容积均为1L的恒容密闭容器中发生反应:
℃吋,在四个容积均为1L的恒容密闭容器中发生反应:
![]()
![]() ,测得有关实验数据如下:
,测得有关实验数据如下:
容器编号 | 物质的起始浓度( | 物质的平衡浓度( | |
|
|
| |
Ⅰ |
|
|
|
Ⅱ |
|
| |
Ⅲ |
|
| |
Ⅳ |
|
| |
①平衡时,容器Ⅱ与Ⅳ容器的总压强之比___________。
②温度不变,容器Ⅲ中达到平衡后再充入NO、![]() (g)各
(g)各![]() mol,则反应将向_____________。(填“正”或“逆”)方向进行。
mol,则反应将向_____________。(填“正”或“逆”)方向进行。
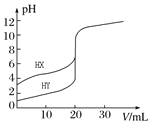
(3)常温下用0.100![]() 盐酸分别滴定10.00mL浓度均为0.100
盐酸分别滴定10.00mL浓度均为0.100![]() 的NaOH溶液和二甲胺[
的NaOH溶液和二甲胺[![]() ]
]

①a、b、c、d四点的水溶液中,由水电离出氢离子浓度大于![]()
![]() 的是________________,原因为_____________________。
的是________________,原因为_____________________。
②化学反应往往伴有热效应若为绝热体系a的温度______________(填“>”,“=”或“<”)c点的温度。